
| A. | BF3和CCl4 | B. | CO2和BeCl2 | C. | NH4+和H3O+ | D. | O3和SO3 |
分析 根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断.
解答 解:A.BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以分子构型为平面正三角形,CCl4分子中C原子价层电子对个数均为4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以CCl4分子为正四面体结构,故A错误;
B.CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(4-2×2)=2,所以二氧化碳是直线型结构,BeCl2中Be价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(2-2)=2,是sp杂化,是直线型结构,二者空间构型相同,故B正确;
C.NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故C错误;
D.O3中价层电子对个数都是3且含有一对孤电子对,所以分子空间构型是V形,SO3中电子对数=$\frac{1}{2}$,S原子采取sp3杂化,分子空间构型为平面三角形,故D错误.
故选:B.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对为解答关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
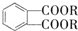 (代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其蒸气对氢气的相对密度为97.工业上生产DMP的流程如图所示:
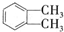 的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.
的名称1,2-二甲苯(或邻二甲苯),C中官能团的名称为醛基,DMP的分子式为C10H10O4.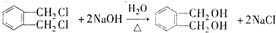 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
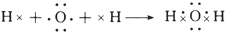 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O的原子结构示意图: | B. | 中子数为8的氮原子:${\;}_{8}^{15}$N | ||
| C. | 次氯酸的电子式: | D. | NH4+的结构式: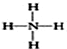 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com