


科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入2滴含[Fe(CN)6]3-溶液,出现蓝色沉淀. | 该溶液中一定含有Fe2+ |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体是NH3 |
| D | 将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
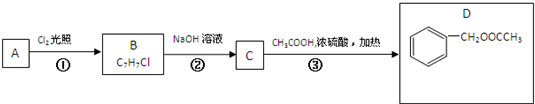
 基团的同分异构体有
基团的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
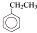
| CO4AlCl3.HCl |
| △ |
| M |
| OH- |
| -H2O |
| △ |
| C |
| (C11H12O) |
| ①Cu(OH)2 |
| ①酸化 |
| CH3OH |
| 浓H2SO4/△ |
| 催化剂 |
| F |
| (高聚物) |
 +CO
+CO| Al3.HCl |
| △ |
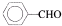
| OH- |
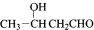
| -H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第3周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙炔分子中有6个σ键,2个π键 |
| B、丙炔分子中3个碳原子都是sp杂化 |
| C、丙炔分子中只存在极性键 |
| D、丙炔分子中的π键比σ键稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
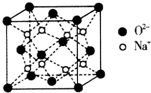 H、C、N、O、Na、Fe、Cu是常见的七种元素.
H、C、N、O、Na、Fe、Cu是常见的七种元素.查看答案和解析>>
科目:高中化学 来源: 题型:
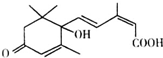 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图.下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图.下列关于该物质的说法正确的是( )| A、该有机物的分子式为C15H21O4 |
| B、该有机物能发生取代、加成和水解反应 |
| C、1 mol该有机物与足量溴反应最多消耗4 mol Br2 |
| D、1 mol该有机物与足量Na反应生成1 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2 能使漂白粉水溶液先变浑浊后变澄清,SO2 也有同样现象 |
| B、加热条件下,Na与O2 反应生成Na2O2,Li与O2反应也声称Li2O2 |
| C、常温下,浓硝酸能使铁、铝钝化,浓硫酸也能使铁、铝钝化 |
| D、氯气可置换出KI溶液中的碘,氟气也可置换出KI溶液中的碘 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com