


| ||
| ||
| C2V2 |
| 6 |
| C2V2 |
| 6 |
| C2V2 |
| 6 |
| C2V2 |
| 6 |


科目:高中化学 来源: 题型:
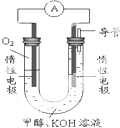 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
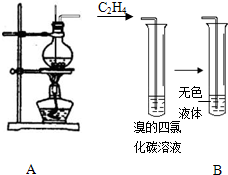 某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.
某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.查看答案和解析>>
科目:高中化学 来源: 题型:
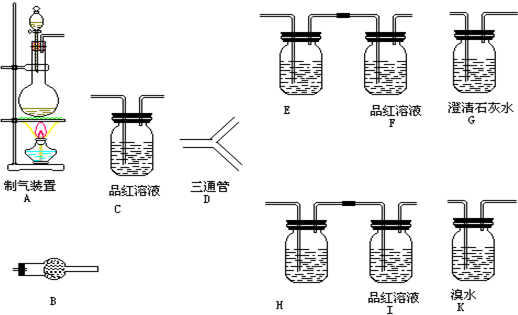
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| Y | Z | W |
| A、原子半径:Y<Z<W |
| B、气态氢化物的稳定性:X>Z |
| C、W的最高价氧化物与水反应形成的化合物是离子化合物 |
| D、X的气态氢化物的水溶液能与Y的最高价氧化物对应水化物发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
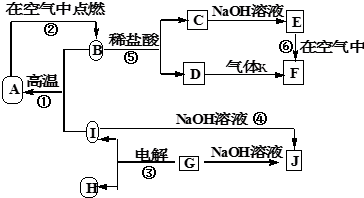
查看答案和解析>>
科目:高中化学 来源: 题型:
A、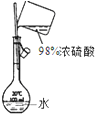 配制稀硫酸溶液 |
B、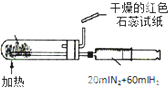 合成氨并检验氨的生成 |
C、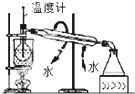 碘的CCl4溶液中分离I2并收回CCl4 |
D、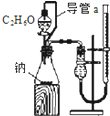 测定乙醇分子结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com