
【题目】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____;B_____;E_____;F_________。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________。
(3)写出电解CD2的化学方程式:_____。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
元素 | E | F | |
电离能/ kJ·mol1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____,F元素在周期表中的位置是_____。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____。
【答案】O Na Mn Fe Na2O、Na2O2 MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑ ![]() 第四周期第VIII族 Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
第四周期第VIII族 Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
【解析】
A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期,已知A是自然界中含量最多的元素,则A为O;B、C、D同周期,且B在同周期元素中第一电离能最小,则B为Na;C的第一、二、三电离能分别为738 kJ·mol1、1451 kJ·mol1、7733 kJ·mol1,则C为Mg;D在同周期元素中(除稀有气体元素外)第一电离能最大,则D为Cl;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7,则E为Mn;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子,则F为Fe。
(1)四种元素的元素符号:A:O;B:Na;E:Mn;F:Fe;故答案为:O;Na;Mn;Fe。
(2)A、B两种元素组成的所有化合物的化学式:Na2O、Na2O2;故答案为:Na2O、Na2O2。
(3)电解熔融MgCl2得到镁和氯气,其化学方程式:MgCl2(熔融) ![]() Mg+Cl2↑;故答案为:MgCl2(熔融)
Mg+Cl2↑;故答案为:MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。
(4)E元素位于第ⅦB族,基态E2+的价电子为3d5,其价电子排布图:![]() ,F元素电子排布式为1s22s22p63s23p63d64s2,因此在周期表中的位置是第四周期第VIII族。比较两元素的I2、I3可知,气态基态Mn2+再失去1个电子比气态基态Fe2+再失去1个电子更难,因为Mn2+:3d5,Fe2+:3d6,Mn2+:3d5半满,稳定结构,难失去电子,而Fe2+:3d6易失去1个电子转变为稳定的结构;故答案为:
,F元素电子排布式为1s22s22p63s23p63d64s2,因此在周期表中的位置是第四周期第VIII族。比较两元素的I2、I3可知,气态基态Mn2+再失去1个电子比气态基态Fe2+再失去1个电子更难,因为Mn2+:3d5,Fe2+:3d6,Mn2+:3d5半满,稳定结构,难失去电子,而Fe2+:3d6易失去1个电子转变为稳定的结构;故答案为:![]() ;Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
;Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。


科目:高中化学 来源: 题型:
【题目】在氧气中充分燃烧0.2 mol某有机物,得到0.4 molCO2和10.8 g H2O,由此可得出的结论是( )
A.该有机物分子中只含有2个碳原子和6个氢原子
B.该有机物中碳元素和氢元素的原子个数比为3∶1
C.该有机物分子中含有2个CO2和3个H2O
D.该有机物分子中含有2个碳原子和6个氢原子,可能含有氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是
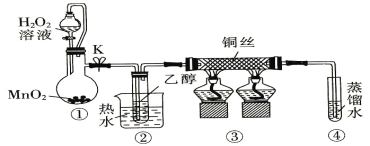
A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60 晶体的晶胞结构如图所示,下列说法正确的是( )
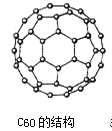
A.该晶体熔化时需克服共价键
B.1个晶胞中含有 8 个 C60 分子
C.晶体中 1 个 C60 分子有 12 个紧邻的C60 分子,属于分子密堆积类型
D.晶体中 C60 分子间以范德华力结合,故 C60 分子的热稳定性较差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图转化的是

甲 | 乙 | 丙 | |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | NH3 | NO | HNO3 |
C | AlCl3 | Al(OH)3 | Al2O3 |
D | Cl2 | HCl | CuCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据某有机物的结构:
(1)测定实验式:某含碳、氢、氧三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为______,分子式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)![]() pC(OH-)
pC(OH-)![]()
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2溶液中,pC(Cl-)![]() 2pC(Ba2+)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的分子式为C4HmO,下列说法错误的是( )
A.1 mol该有机物完全燃烧时,最多消耗6 mol O2
B.当m=6时,该有机物遇到FeCl3溶液发生显色反应
C.当m=8时,该有机物不一定能被新制氢氧化铜悬浊液氧化
D.当m=10时,该有机物不一定是丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的氢化物是广泛的化工原料,回答下列问题:
(1)工业上合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。
2NH3(g) △H=-92.2kJ/mol,反应过程中能量变化如图I所示。

①氨分解:2NH3(g)![]() N2(g)+3H2(g)的活化能为_________kJ/mol
N2(g)+3H2(g)的活化能为_________kJ/mol
②合成氨时加入铁粉可以加快生成NH3的速率,在图I中画出加入铁粉后的能量变化曲线。_______
(2)联氨作火箭燃料的反应为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) △H1
已知:2O2(g)+N2(g)=N2O4(1) △H2 N2H4(1)+O2(g)=N2(g)+2H2O(g) △H3
上述热效应之间的关系式为△H1=____。某新型火箭用液氧/煤油代替联氨/N2O4,这种替换可能的好处是___(一条即可)。
(3)天然气制氢气是工业上制氢气的主要方法之一,其主要反应如下:
i.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
CO(g)+3H2(g) ΔH=-+206.4kJ/mol,
ii.CO(g)+ H2O(g)![]() CO2(g)+H2(g) ΔH=-41.0kJ/mol
CO2(g)+H2(g) ΔH=-41.0kJ/mol
在一定温度下,2L的密闭容器中加入a molCH4和2amolH2O发生反应,t min时反应达平衡,测得容器内CObmol、CO2cmol。回答下列问题:
①下列可判断体系达到平衡状态的是_______。
A.CO的体积分数不变 B.容器内气体密度不变 C.3v(CH4)=v(H2) D.![]() 不再变化
不再变化
②0~tmin反应速率v(CO2)=_____,CH4的的转化率为_____,反应ⅱ的平衡常数K=______。
③图Ⅱ中T℃之后c(CO2)随温度升高而减小的原因是_________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com