
下列变化只需通过一步化学反应就可以实现的是
A. S→SO3 B. Al2O3→Al(OH)3 C. SiO2→H2SiO3 D. Na2CO3→NaHCO3
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源:2016-2017学年河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:简答题
Ⅰ.常温下,将除去表面氧化膜的Al、Cu片放入U形管作原电池的两极,测得图1所示原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
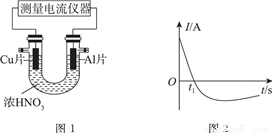
(1)0~t1时,原电池的负极是Al片,此时,正极的电极反应式是________。溶液中的H+向________(填“正”或“负”)极移动。
(2)t1时,原电池中电子流动方向发生改变,其原因是________。
Ⅱ.下图所示电化学装置中,a为足量的电解质溶液,X、Y是两块电极板。
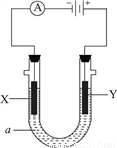
请回答:
(3)若X、Y都是石墨电极,a是含有酚酞的饱和NaCl溶液,则在X电极附近观察到的现象是________,检验Y电极上反应产物的化学方法及实验现象是________,电解池总反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省濮阳市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、B、C、的单质, x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且y可用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是
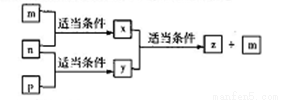
A. D的单质起火燃烧时可用y作灭火剂
B. 元素的非金属性:C>A>B>D
C. B、C、D与A形成的简单化合物的熔点:C>D>B
D. 原子半径:D>B>C>A
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A. 氨气极易溶解于水且溶解的快,因此可用来做喷泉实验
B. 实验室可用氢氧化钠溶液处理含有二氧化硫或氯气的尾气
C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D. 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子在酸性溶液中能大量共存的是
A. Fe3+、NH4+、SCN-、Cl- B. Na+、Mg2+、NO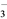 、SO42-
、SO42-
C. Al3+、Fe2+、NO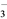 、Cl- D. K+、Na+、Cl-、SiO32-
、Cl- D. K+、Na+、Cl-、SiO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列行为符合安全要求的是
A. 实验室制取氨气时,将尾气直接通入水中吸收
B. 金属钠着火,立即用泡沫灭火器灭火
C. 大量氯气泄漏时,迅速离开现场并尽量往高处去
D. 皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗
查看答案和解析>>
科目:高中化学 来源:2017届海南省琼海市高三下学期第一次月考化学试卷(解析版) 题型:填空题
(1)已知一氧化碳与水蒸气的反应为: CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
在427 ℃ 时的平衡常数是9。如果反应开始时,一氧化碳和水蒸气的浓度都是0. 01 mol/L,则一氧化碳在此反应条件下的转化率为___________。
(2)规律是对经常出现的客观现象的归纳。规律越普遍,适用性或预言性也就越强,然而,任何规律都有其适用范围。
① 某同学在实验中发现,将H2S气体通入CuSO4溶液中,生成了黑色沉淀。请写出反应的化学方程式 ____________。
② 酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中可完全电离。在液氨中,反应CH3COONa + HCl = NaCl + CH3COOH _______(填“能”或“不能”)发生,理由是______________。
查看答案和解析>>
科目:高中化学 来源:2017届四川外语学院重庆第二外国语学校高三下学期第二次检测理科综合化学试卷(解析版) 题型:填空题
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,请回答下列问题:
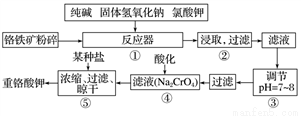
(1)以上工艺流程所涉及元素中属于过渡元素的有________,铁在周期表中的位置是第______周期______族。
(2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式:_________________。
(3)NaFeO2能发生强烈水解,在步骤②中生成沉淀而除去,写出该反应的化学方程式:_________________。
(4)流程④中酸化所用的酸和流程⑤中所用的某种盐最合适的是____________(填字母)。
A.盐酸和氯化钾 B.硫酸和氯化钾 C.硫酸和硫酸锌 D.次氯酸和次氯酸钾
酸化时,CrO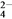 转化为Cr2O
转化为Cr2O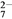 ,写出平衡转化的离子方程式:________________。
,写出平衡转化的离子方程式:________________。
(5)水溶液中的H+是以H3O+的形式存在,H3O+的电子式为_____________。
(6)简要叙述操作③的目的:________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省葫芦岛市高三上学期第二次周考理综化学试卷(解析版) 题型:实验题
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15 g /100 mL。莫尔法是较简单的一种测量Cl-含量的方法。现采用该法测量某市售酱油是否符合NaCl含量标准要求。实验原理如下(25℃):Ag++ Cl-=" AgCl" (白色)Ksp(AgCl)=1.8×l0-10
2 Ag++ Cr042-= Ag2Cr04(砖红色)Ksp(Ag2Cr04)=1.2×10-12
准确移取酱油样品5.00 mL稀释至100 mL,从其中取出10.00 mL置于锥形瓶中,再向其中加入适量的铬酸钾溶液,以0.1000 mol/L的硝酸银标准溶液滴定,重复实验三次。
(1)样品稀释过程中,用 移取酱油样品,应在 中定容,还需用到的玻璃
仪器有_____________。
(2)标准硝酸银溶液用棕色滴定管盛装的原因是__________。滴定中眼睛应注视 ,出现 即达到滴定终点。
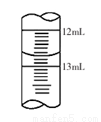
(3)滴定结束时,滴定管中液面如上图所示,则读数为_____________。
(4)若三次消耗硝酸银标准溶液的平均体积为12.50 mL,则稀释后的酱油中NaCl的浓度为 mol/L,该市售酱油是否符合NaCl含量标准 (填“符合”或“不符合”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com