
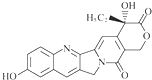
| A. | 可以与溴水反应 | |
| B. | 可以与FeCl3溶液发生显色反应 | |
| C. | 可以与浓HBr溶液反应 | |
| D. | 一定条件下,1 mol该物质最多可与1 mol NaOH反应 |
科目:高中化学 来源: 题型:解答题
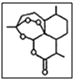 ,其中的过氧基(-O-O-)具有强氧化性.请回答下列问题:
,其中的过氧基(-O-O-)具有强氧化性.请回答下列问题: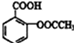 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: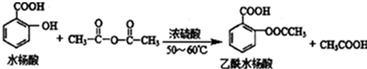
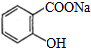 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C和 14N 质子数相差 1,中子数也相差1 | |
| B. | 一种元素可以有多种核素,有几种核素就有几种原子 | |
| C. | 钴5627Co、5727Co、5827Co、5927Co等几种原子,他们是同素异形体,其物理性质几乎相同,化学性质不同 | |
| D. | 核聚变如21H+31H→42He+10 n,由于有新微粒生成,该变化是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 化学反应中,反应物总能量与生成物总能量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
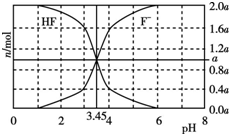 25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用2a mol•L-1NaOH溶液滴定1.0L2a mol•L-1HF溶液,得到混合液中HF、F-的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | pH=3时,溶液中:c(Na+)<c(F-) | |
| B. | 当c(F-)>c(HF)时,一定有c(OH-)>c(H+) | |
| C. | pH=3.45时,NaOH溶液与HF恰好完全反应 | |
| D. | pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应为:O2+2H2O+4e-═4OH- | |
| B. | 放电时CO32-向负极移动 | |
| C. | 电池供应1mol水蒸气,转移电子4mol | |
| D. | 放电时正极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com