
科目:高中化学 来源: 题型:选择题
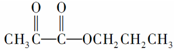 ,最简便的流程需要下列反应的顺序是
,最简便的流程需要下列反应的顺序是| A. | b d f g h | B. | e a d c h | C. | b a e c h | D. | e d c a h |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
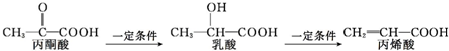
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1 mol乳酸最多能与2 mol Na发生反应 | |
| D. | 三种有机物均能发生聚合反应生成高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
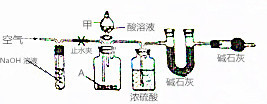 碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:
碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(OH)x(CO3)y•zH2O.某校化学兴趣小组欲测定其化学式,实验设计如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com