
| A、3:4 | B、4:5 |
| C、2:3 | D、3:2 |
| ||
| ||
| a |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 1 |
| 2 |
| a |
| b |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
| A、用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
| B、甲酸与乙二酸互为同系物 |
| C、用浓Na2SO4、CuSO4溶液或浓硝酸溶液使蛋清液发生盐析,进而分离、提纯蛋白质 |
D、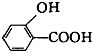 (水杨酸)与足量的NaHCO3溶液反应可生成 (水杨酸)与足量的NaHCO3溶液反应可生成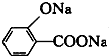 、CO2和H2O 、CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
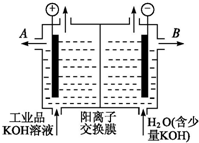 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① | B、只有② |
| C、只有③ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
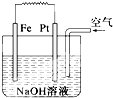
| A、这是电解NaOH溶液的装置 |
| B、该装置中Pt为正极,电极反应为O2+2H2O+4e-═4OH- |
| C、该装置中Fe为负极,电极反应为Fe-2e-═Fe2+ |
| D、这是一个原电池装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、Al3+、Cl-、SO42- |
| B、K+、Na+、SO32-、SO42- |
| C、Ag+、Ca2+、NH4+、NO3- |
| D、Na+、Ba2+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:4 | B、1:9 |
| C、2:3 | D、2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com