
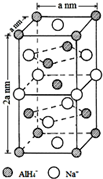
 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
.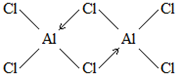 (标明配位键).
(标明配位键).分析 (1)Ti是22号元素,其3d、4s电子为其价电子,根据构造原理书写其价电子轨道表示式;
(2)含有离子键的晶体为离子晶体,NaH中钠离子和氢离子之间存在离子键;
(3)分子晶体熔沸点较低,氯化铝的熔沸点较低,说明氯化铝是分子晶体,其蒸气的相对分子质量约为267,说明该分子中含有两个AlCl3,配位键由含有孤电子对的原子指向含有空轨道的原子;
(4)AlH4-中Al原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断Al原子杂化方式;
等电子体的结构和性质相似,原子个数相等、价电子数相等的微粒互为等电子体;
(5)根据图知,与Na+紧邻且等距的AlH4-有8个;该晶胞中钠离子个数=6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,AlH4-个数=
1+8×$\frac{1}{8}$+$\frac{1}{2}$×4=4,其体积=(a×a×2a)×10-21 cm3,其密度=$\frac{m}{V}$;若NaAlH4晶胞底心处的Na+被Li+取代,实际上该晶胞中有一个钠离子被锂离子取代;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒书写方程式.
解答 解:(1)Ti是22号元素,其3d、4s电子为其价电子,根据构造原理书写其价电子轨道表示式为 ,
,
故答案为: ;
;
(2)含有离子键的晶体为离子晶体,NaH中钠离子和氢离子之间存在离子键,所以属于离子晶体,其电子式为 ,故答案为:离子;
,故答案为:离子; ;
;
(3)分子晶体熔沸点较低,氯化铝的熔沸点较低,说明氯化铝是分子晶体,其蒸气的相对分子质量约为267,说明该分子中含有两个AlCl3,配位键由含有孤电子对的原子指向含有空轨道的原子,铝原子含有空轨道、氯原子含有孤电子对,所以配位键由氯原子指向铝原子,则蒸气分子结构式为 ,
,
故答案为: ;
;
(4)AlH4-中Al原子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断Al原子杂化方式为sp3杂化,为正四面体构型,与AlH4-空间构型相同的两种离子为NH4+、SO42-等,
故答案为:sp3杂化;NH4+、SO42-等;
(5)根据图知,与Na+紧邻且等距的AlH4-有8个;该晶胞中钠离子个数=6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,AlH4-个数=
1+8×$\frac{1}{8}$+$\frac{1}{2}$×4=4,其体积=(a×a×2a)×10-21 cm3,其密度=$\frac{m}{V}$=$\frac{\frac{54}{{N}_{A}}×4}{2{a}^{3}×1{0}^{-21}}$g•cm-3=$\frac{108×1{0}^{21}}{{a}^{3}{N}_{A}}$g•cm-3,
若NaAlH4晶胞底心处的Na+被Li+取代,实际上该晶胞中有一个钠离子被锂离子取代,所以其化学式为Na3Li(AlH4)4,
故答案为:8;$\frac{108×1{0}^{21}}{{a}^{3}{N}_{A}}$;Na3Li(AlH4)4;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4=Na3AlH6+2Al+3H2,
故答案为:3NaAlH4═Na3AlH6+2Al+3H2↑.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、配位键、原子核外电子排布等知识点,侧重考查学生分析判断、知识综合运用及空间想象能力,明确原子结构、物质结构是解本题关键,易错点是配位数个数的计算方法.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的氯化铁溶液中:Na+、K+、Br-、SCN- | |
| B. | 水电离出的氢氧根离子浓度为10-13mol/L的溶液中:NH4+、K+、SiO32-、SO42? | |
| C. | 使酚酞试液变红色的溶液中:Na+、K+、HCO3-、S2? | |
| D. | 澄清透明的溶液中:K+、Ca2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
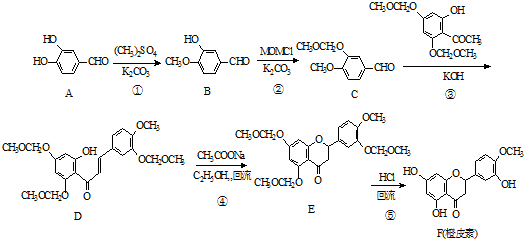
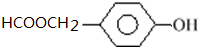 .
.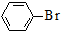 和CH3CHO为原料制备化合物
和CH3CHO为原料制备化合物 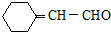 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| C. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 | |
| D. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合、氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 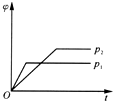 | B. | 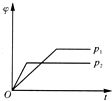 | C. | 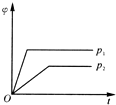 | D. | 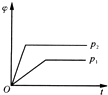 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5g | |
| B. | 0.5 mol CO2 中所含的CO2 分子数为 3.01×1023 | |
| C. | 标准状况下,6.02×1022 个CO2 所占的体积约是 22.4 升 | |
| D. | 在 l L 水中溶解5.85g NaCl固体,即可配制得0.1 mo1/L 的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
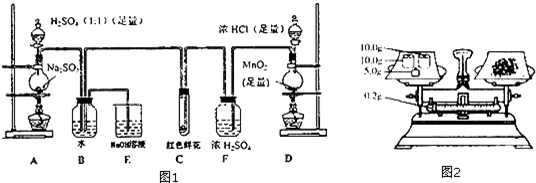
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Cl-<Mg2+<Na+ | B. | 非金属性:Si<C<N | ||
| C. | 碱性:Mg(OH)2<NaOH<KOH | D. | 稳定性:PH3<NH3<H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com