
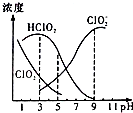
 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )| A. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 使用该漂白剂的最佳pH为3.0 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
分析 A.由图可知,亚氯酸与亚氯酸根离子浓度相等时,溶液的pH=6,结合图示数据来计算;
B.根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
C.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2),据此计算解答即可.
D.NaClO2溶液中ClO2-水解显碱性.
解答 解:A.由图可知,亚氯酸与亚氯酸根离子浓度相等时,溶液的pH=6,结合图示数据可知,溶液中c(ClO2-)=c(HClO2),HClO2的电离平衡常数K=$\frac{c({H}^{+})×c(Cl{{O}_{2}}^{-})}{c(HCl{O}_{2})}$=10-6,故A正确;
B.HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图象知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,当溶液的pH为4.0~5时二者兼顾,即为使用该漂白剂的最佳pH,应该是4-5,故B错误;
C.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-) ①,依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-),故C正确;
D.NaClO2溶液中ClO2-水解显碱性,则c(OH-)>c(H+),由于水解程度较小,所以溶液中离子浓度大小关系为:c(Na+)>c(ClO2-)>c(OH-)>c(H+),故D正确.
故选B.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.


科目:高中化学 来源: 题型:选择题
| Q | X | ||
| Y | Z | W | |
| T |
| A. | X、Z、Y元素的原子半径及它们的气态氢化物的热稳定性均依次递增 | |
| B. | Y、Z、W元素在自然界中均能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | Q与氢元素形成的化合物中不存在非极性共价键 | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,最高价氧化物对应水化物的化学式是H3TO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
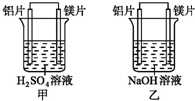 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为106 | B. | 质子数为46 | C. | 电子数为46 | D. | 中子数为46 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com