
某强酸性溶液X含有Ba2+、Al3+、N 、Fe2+、Fe3+、C
、Fe2+、Fe3+、C 、S
、S 、S
、S 、Cl-、N
、Cl-、N 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是 ;不能确定是否含有的离子是 ,若要确定其中阳离子的存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:
步骤①中生成A 。
步骤②生成沉淀I 。
(4)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,当沉淀C物质的量(填:“<”或“=”或“>”某个值) mol,表明不能确定是否含有的离子中一定存在 。(若不止一种可能,填一种情况即可) 
科目:高中化学 来源: 题型:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:

(1)“酸浸”中硫酸要适当过量,目的是 ▲ 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 ▲ 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定。有关反应的化学方程式如下:
2Fe3++Sn2++6Cl—=2Fe2++SnCl62—
Sn2++4Cl—+2HgCl2=SnCl62-+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
滴定时,K2Cr2O7标准溶液应盛放在 ▲ 滴定管中(填“酸式”、“碱式”);若不加HgCl2,则测定的Fe3+量 ▲ (填“偏高”、“偏低”或“不变”)。
(4)①可选用 ▲ (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 ▲ (用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ▲ 。
b.沉淀: ▲ 。
c.分离,洗涤。
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
在铜锌硫酸原电池中,锌为 极, 电子,电极发生的是 反应(填氧化或还原),电极反应式为 ;铜为 极, 电子,电极发生的是 反应,电极反应式为 ,铜片上观察到的现象为 ,总反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | |
| ② | KMnO4 |
| O2 | MnO2 |
| ③ | KClO3 | 浓盐酸 | Cl2 | |
| ④ | KMnO4 | 浓盐酸 | Cl2 | MnCl2 |
A.表中①反应的氧化产物只能有FeCl3
B.表中②生成1mol的O2将有4mol的电子转移
C.表中④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍。则下列判断正确的是
A.两种单质的摩尔质量比为1∶4 B.生成物C中A的质量分数为75%
C.生成物C中A、B的原子个数比为3∶1 D.反应前后气体分子数比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,已知:4Al(s)+3O2(g)==== 2Al2O3(s)ΔH1 、
4Fe(s)+3O2(g)==== 2Fe2O3(s)ΔH2,关于ΔH1、ΔH2的比较正确的是( )
A.ΔH1>ΔH2 B. ΔH1=ΔH2 C. ΔH1<ΔH2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应式为:4Al + 3O2 +6H2O ===4Al(OH)3下列说法不正确的是
A.电池工作时,电流由铝电极沿导线流向铂电极
B.正极反应式为:O2 + 2H2O +4e- === 4OH-
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 1mol SO42﹣的质量是96g | B. | 1mol H2O的质量是18g/mol |
|
| C. | CO2的摩尔质量是44g | D. | HCl的相对分子质量是36.5g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组欲探究SO2的化学性质,设计了如下实验方案。
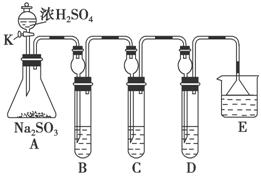
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
| 实验操作 | 预期现象和结论 |
| 将D中沉淀过滤,洗涤干净备用 | |
| 用另一干净试管取少量沉淀样品,加入______ __ ______ | __________ _______ ___ ____ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com