
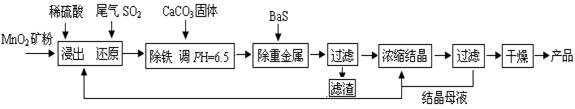
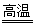
 Mn3O4 + SO2↑+ 2SO3↑+ 3H2O (3分)
Mn3O4 + SO2↑+ 2SO3↑+ 3H2O (3分)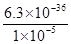 =6.3×10-31 mol/L。
=6.3×10-31 mol/L。 Mn3O4 + SO2↑+ 2SO3↑+ 3H2O。
Mn3O4 + SO2↑+ 2SO3↑+ 3H2O。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源:不详 题型:填空题
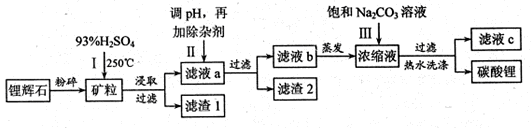
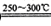 Li2SO4+Al2O3·4SiO2?H2O
Li2SO4+Al2O3·4SiO2?H2O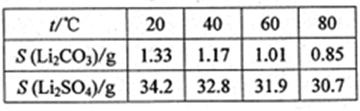
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
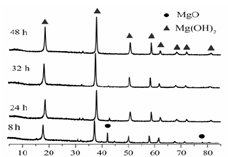
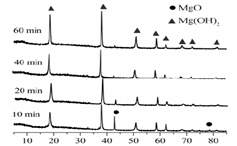
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏法能从海水中提取淡水 |
| B.从海水中可以得到氯化镁,再加热分解可制金属镁 |
| C.用氯气从海水中提溴的关键反应是Cl2+2Br-= 2Cl-+Br2 |
D.煤的气化主要反应是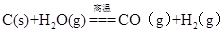 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.推广可利用太阳能、风能的城市照明系统 |
| B.使用填埋法处理未经分类的生活垃圾 |
| C.加速建设地铁、轻轨等轨道交通,减少汽车尾气排放 |
| D.积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解水 | B.锌和稀硫酸反应 | C.光解海水 | D.以石油和天然气为原料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
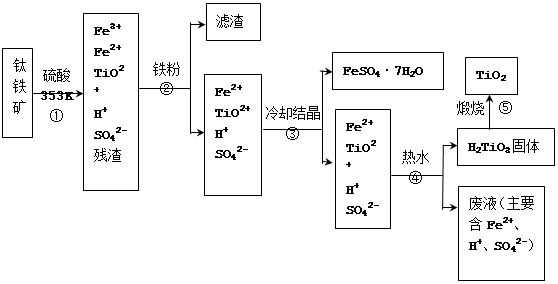
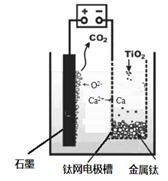
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com