
分析 ①能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应;
②负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
③用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时电解质溶液中生成氢氧根离子.
解答 解:①能设计成原电池的化学反应必须是自发进行的放热的氧化还原反应,
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,该反应是吸热反应,所以不能设计成原电池,故错误;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,该反应是不是氧化还原反应,所以不能设计成原电池,故错误;
C.2H2(g)+O2(g)=2H2O(l)△H<0,该反应是自发进行的放热的氧化还原反应,所以能设计成原电池,故正确;
故选C;
②正极上氧化剂得电子发生还原反应,电极反应式为:O2+4 H2O+4e-=4OH-,
故答案为:O2+4 H2O+4e-=4OH-;
③用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时电解质溶液中生成氢氧根离子,电池反应式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-.
点评 本题涉及原电池和电解池原理等知识点,明确原电池反应特点、电解池中离子放电顺序等知识点即可解答,这些知识点都是高考热点,一般都在综合性题中出现,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 若负载为铅蓄电池,则在对铅蓄电池充电时与Cu极相连的一极发生还原反应. | |
| C. | 通空气时时,正极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
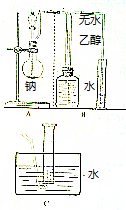 乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.
乙醇的分子式为C2H6O,有人设计了如图所示的实验来确定乙醇分子的结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ②③⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 杭州市萧山区红山农场近期完成了天然气管道安装,从此每家每户结束液化煤气使用时代,这一举措有利于降低氮氧化合物的排放 | |
| B. | 电动汽车、甲醇燃料汽车的出现,有利于节能减排,保护环境 | |
| C. | 利用天阳能等清洁能源代替化石燃料,有利于节约资源,造福后代 | |
| D. | 2015年春节期间,烟花爆竹的燃放时间比往年减少一天,市民也自觉减少烟花的燃放量,这有利于减少雾霾天气的出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、基态Z原子的价层电子排布图
、基态Z原子的价层电子排布图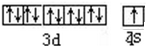 .从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光
.从光谱的角度解释Z原子特征焰色产生原因:铜原子的外层电子在发生跃迁时会一定波长的光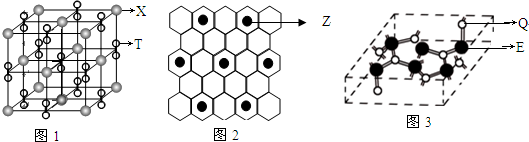
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 1:1 | D. | 4:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com