
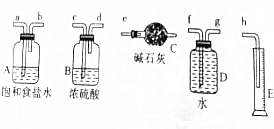
分析 (1)①根据实验发生装置→除杂装置→吸收测定装置排序;
②若测定Cl2的体积时不用干燥直接利用排水收集氯气即可;
(2)测量质量时,碱石灰的细口部分应加防止空气中二氧化碳气体进入的装置,测定体积时使用的仪器更少;
(3)测量氯气体积时,由于气体体积受温度和压强影响,要保证温度、压强不变;
(4)若选择测量Cl2的质量时结果测出的值偏大,说明碱石灰除了吸收氯气以为还吸收了其他酸性气体或者氯气未净化.
解答 解:(1)①漂白精与浓盐酸中反应生成的氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,进入干燥管用碱石灰吸收以测定氯气的质量,所以测定Cl2的质量时各仪器的连接顺序为a,b,c,d,e,
故答案为:a,b,c,d,e;
②若测定Cl2的体积时不用干燥,将产生的氯气通入装置D,利用量筒测量排出的水的体积即为氯气的体积,所以测定Cl2的体积时可选择的仪器有D、E,
故答案为:D、E;
(2)测量质量时,碱石灰的细口部分应加防止空气中二氧化碳气体进入的装置,则需要更多实验仪器,而测定体积时使用的仪器更少,更简便,
故答案为:测体积较方便;
(3)测量氯气体积时,由于气体体积受温度和压强影响,可将气体冷却至室温,将量筒和集气瓶中液面调节至相平以及视线与液面相平以保证温度和压强的不变,
故答案为:将气体冷却至室温;将量筒和集气瓶中液面调节至相平;视线与液面相平;
(4)若选择测量Cl2的质量时结果测出的值偏大,说明碱石灰除了吸收氯气以为还吸收了其他酸性气体或者氯气未净化,使得碱石灰增加的质量增多,
故答案为:气体未净化;碱石灰吸收了空气中的水或CO2.
点评 本题考查氯气的实验室制备测定,明确测量原理是解题关键,题目难度不大,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
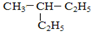 和
和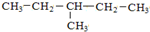
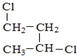 与
与 ④H2O和D2O
④H2O和D2O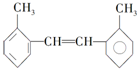 其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.
其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
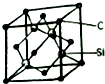 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: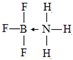 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com