
下列有关物质的性质与应用相对应的是
A.碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污
B.铝易发生钝化,可用于作飞机、火箭的结构材料
C.炭具有还原性,可用于冶炼钠、镁、铝等金属
D.浓硫酸具有强氧化性,可用于干燥二氧化硫气体
科目:高中化学 来源: 题型:选择题
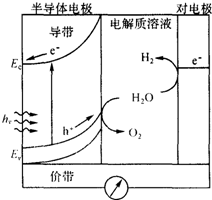 太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )
太阳能发电和阳光分解水制氢气,是清洁能源研究的主攻方向,研究工作之一集中在n-型半导体光电化学电池方面.如图是n-型半导体光电化学电池光解水制氢的基本原理示意图,图中的半导体导带是未充填电子的能级最低的能带,半导体价带是已充填价电子的能级最高的能带,图中的e-为电子、h+为空穴.在光照下,电子(e-)由价带跃迁到导带后,然后流向对电极.下列说法不正确的是( )| A. | 对电极表面发生的电极反应式为:4H++4e-→2H2 | |
| B. | 电池的总反应式为:2H2O$\stackrel{hv}{→}$O2+2H2↑ | |
| C. | 整个过程中实现了太阳能向电能化学能等的转化 | |
| D. | 装置中电流的方向是从半导体电极流向对电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相等时具有的质量相等 | B. | 分子数相等时具有的中子数相等 | ||
| C. | 质量相等时具有的质子数相等 | D. | 体积相等时具有的原子数相等 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
硫酸钙可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是
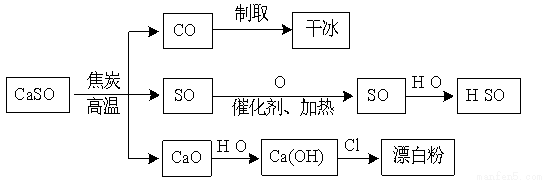
A.CO2制取干冰的过程吸收热量,属于物理变化
B.硫酸钙与焦炭反应时生成的n(CO2):n(SO2)=1:2
C.由SO2制取H2SO4的过程均为氧化还原反应
D.石灰乳与Cl2反应制取漂白粉时,Cl2仅作还原剂
查看答案和解析>>
科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题

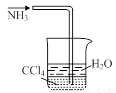
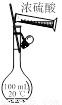
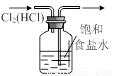
图甲 图乙 图丙 图丁
A. 用图甲所示装置验证反应产物二氧化碳
B. 用图乙装置吸收氨气并防止倒吸
C. 图甲装置配制100 mL 1 mol·L-1的硫酸
D. 用图丁装置除去氯气中的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
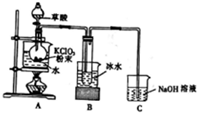 二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:
二氧化氯(ClO2)是一种高效消毒剂,在60℃时用氯酸钾与草酸(中强酸)反应可制备二氧化氯,实验装置如图所示.已知:通常情况下,二氧化氯的沸点为11.0℃,极易爆炸,制取和使用二氧化氯时要用性质确定的气体稀释,以防爆炸,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>HBr>HI | ||
| C. | 酸性强弱:H2SiO4<H2CO3<H2SO4 | D. | 熔点:SiO2>NaCl>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
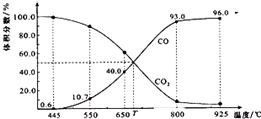 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡不移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.p总 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com