
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示的实验,探究由两种元素组成的某未知无机矿物甲:

下列叙述错误的是( )
A.硫氰化钾的电子式为![]()
B.甲的化学式为Fe5O7
C.丙中滴加稀硝酸没有气体逸出
D.丙中滴加K3[Fe(CN)6]产生蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 溶于
溶于![]() 溶液中,能配制成浓度较大的碘水,主要是发生了反应:
溶液中,能配制成浓度较大的碘水,主要是发生了反应:![]()
![]()
![]() 。该平衡体系中,
。该平衡体系中,![]() 的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态)。下列说法正确的是( )
的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态)。下列说法正确的是( )
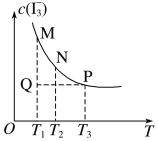
A.反应速率:![]() B.平衡常数:
B.平衡常数:![]()
C.M、N两点相比,M点的![]() 大D.Q点时,
大D.Q点时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氧化钠溶液的玻璃瓶应用橡胶塞的原因是______________(用化学方程式表示);Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.氧化铝坩埚 D.铁坩埚
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
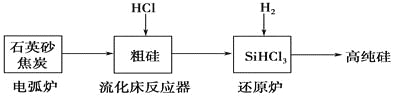
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为____________。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2 355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的化学方程式为_____________。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,,关闭活塞a。
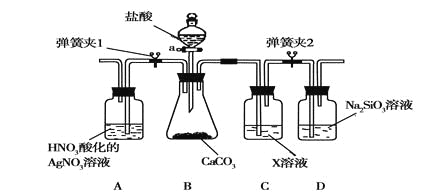
① B中反应的离子方程式是________。
②通过步骤Ⅰ得知盐酸具有的性质是________(填字母)。
A.挥发性 B. 还原性 C. 氧化性 D. 酸性
③ C装置中的试剂X是________(写化学式)。D中反应的化学方程式是________。
④碳、硅的非金属性逐渐减弱的原因:碳和硅______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用软锰矿(主要成分为![]() ,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的
,另含少量铁,铝,铜等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的![]() ,又制得电池材料
,又制得电池材料![]() (反应条件已省略).请回答下列问题:
(反应条件已省略).请回答下列问题:
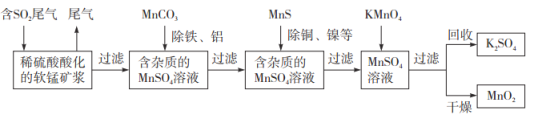
(1)上述流程脱硫实现了________(填编号).
a.废弃物的综合利用 b.“白色污染”的减少
c.酸雨的减少 d.臭氧层空洞的减小
(2)已知:25℃,101kPa时,![]()
![]() ,
,![]()
![]() ,
,![]()
![]() 。则步骤Ⅰ中
。则步骤Ⅰ中![]() 与
与![]() 反应生成无水
反应生成无水![]() 的热化学方程式是__________。
的热化学方程式是__________。
(3)用离子方程式表示出步骤Ⅱ中用![]() 除去
除去![]() 的反应原理:__________。
的反应原理:__________。
(4)已知![]() ;在步骤Ⅲ除铜镍的过程中,当
;在步骤Ⅲ除铜镍的过程中,当![]() 恰好完全沉淀[此时溶液中
恰好完全沉淀[此时溶液中![]() ],则溶液中
],则溶液中![]() 的浓度是_________mol/L。
的浓度是_________mol/L。
(5)步骤Ⅳ生成无水![]() 的化学方程式是___________。
的化学方程式是___________。
(6)产品![]() 可作超级电容材料.用惰性电极电解
可作超级电容材料.用惰性电极电解![]() 溶液可以制得
溶液可以制得![]() ,其阳极的电极反应式是________________________。
,其阳极的电极反应式是________________________。
(7)已知废气中![]() 浓度为
浓度为![]() ,软锰矿浆对
,软锰矿浆对![]() 的吸收率可达90%,则处理
的吸收率可达90%,则处理![]() 燃煤尾气,可得到硫酸锰晶体(
燃煤尾气,可得到硫酸锰晶体(![]() ,相对分子质量为169)的质量为_____kg(结果保留3位有效数字)。
,相对分子质量为169)的质量为_____kg(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)3mol甲烷燃烧时,生成液态水和二氧化碳,同时放出2670.9kJ的热量,写出该反应的热化学方程式___。
(2)当1g氨气完全分解为N2和H2时,吸收2.7kJ的热量,写出其热化学方程式:___。
(3)HCl和NaOH反应的中和热ΔH= -57.3kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式:___。
(4)2g H2完全燃烧生成液态水,放出285.8kJ热量,写出该反应的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,10 mLpH=1的醋酸溶液中含有的氢离子数为0.001NA
B. 合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目等于NA
D. 常温常压下,18.4gNO2和N2O4的混合气体中含有的氮原子总数为0.8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某![]() 的溶液X,其中可能含有
的溶液X,其中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
中的一种或几种,取200 mL该溶液进行实验,其现象及转化如图.
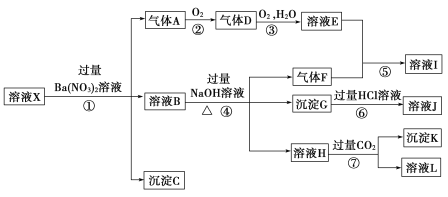
已知:反应过程中有一种气体是红棕色.
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有________.
(2)溶液X中,关于![]() 的判断一定正确的是________(填字母).
的判断一定正确的是________(填字母).
a.一定有 b.一定没有 c.可能有
(3)①中产生气体A的离子方程式为_____________________________________________________.
(4)⑦中生成沉淀K的离子方程式为_____________________________________________________.
(5)溶液X中不能确定的离子是_____________________用实验证明该离子一定不存在的化学方法为______________________________________________________________________________________.
(6)若实验测定A.F.K均为![]() l,试确定沉淀C及其物质的量范围:_________.
l,试确定沉淀C及其物质的量范围:_________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com