
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究。反应原理为:Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O

(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为________________。(填接头序号)
(2)D中盛装的试剂为_________________。
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的_____________,可观察到的现象_________ 。
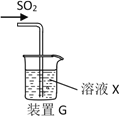
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4,为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L ____和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入_______ 和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3-能将H2SO3氧化为SO42- |
【答案】 a f g d c e (写a f g d c f g e) NaOH溶液(或其它碱液) 氧化性 产生黄色沉淀(黄色浑浊或乳白色沉淀) FeCl3 0.01mol/L HNO3 (或pH=2 的HNO3 )
【解析】试题分析:本题考查SO2的实验室制备和SO2性质探究,实验方案的设计。
(1)根据反应原理,制备SO2属于“固体+液体→气体”;制得的SO2中混有H2O(g),用浓硫酸干燥SO2;SO2密度比空气大,用向上排空法收集;SO2污染大气,最后要进行尾气吸收,所以实验装置连接顺序为afgdce。
(2)D中盛装的试剂吸收SO2尾气,可用NaOH溶液。
(3)若X是Na2S溶液,由于酸性H2SO3![]() H2S,反应的过程为SO2与Na2S溶液作用生成H2S,H2S与SO2作用生成S和H2O,SO2被还原成S,所以实验目的是检验SO2的氧化性,可观察到的现象是:产生黄色沉淀。
H2S,反应的过程为SO2与Na2S溶液作用生成H2S,H2S与SO2作用生成S和H2O,SO2被还原成S,所以实验目的是检验SO2的氧化性,可观察到的现象是:产生黄色沉淀。
(4)白色沉淀为BaSO4,说明H2SO3被氧化成SO42-;根据Fe(NO3)3溶液的性质,可能是Fe3+将H2SO3氧化成SO42-,也可能是酸性条件下的NO3-将H2SO3氧化成SO42-;所以设计实验方案时用控制变量的对比实验。实验2要证明是Fe3+氧化H2SO3,所以选用与Fe(NO3)3含有相同Fe3+浓度的FeCl3溶液进行实验;实验3要证明是酸性条件下NO3-氧化H2SO3,所以选用与Fe(NO3)3溶液等pH的HNO3溶液进行实验。


科目:高中化学 来源: 题型:
【题目】下列事实不能体现乙酸酸性的是( )
A.乙酸滴入碳酸钠溶液中会出现气泡
B.乙酸中滴加几滴石蕊溶液呈红色
C.乙酸和水能以任意比例互溶
D.长时间使用的热水瓶胆可以用乙酸来洗去水垢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.液氨可用作制冷剂B.SO2使湿润的蓝色石蕊试纸变红
C.常温下可以用铁或铝制容器盛装浓硝酸或浓硫酸D.测定某雨水的pH值小于7.0可判断雨水为酸雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾是配制波尔多液的主要原料,常用在树木,花卉的保护上。
(1)基态铜原子的电子排布式为___________。
(2)乙烯氨氧化可以得到丙烯腈(CH2=CH-CN),丙烯腈中各元素的电负性由大到小顺序为____________,1mol丙烯腈分子中含有π键数目为_________。
(3)CN-与N2互为等电子体,写出CN-的电子式______________。
(4)通过X射线衍射发现,胆矾中存在SO42-离子,SO42-离子的VSEPR构型名称为___________,CO32-中心原子的杂化形式为________。
(5)硫酸铜灼烧可以生成一种红色晶体,其结构如图所示为体心立方晶胞,则该化合物的化学式是______;若该晶体中距离最近的铜原子与氧原子直接距离为acm,则晶体密度表达式为_____g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3有毒,在潮湿的空气中可发生水解反应产生大量的白雾。它在实验室和工业上都有重要的应用。在实验室中制取PCl3,在D中放入足量白磷,将Cl2迅速而且不间断地通入D中,氯气与白磷会发生反应,产生火焰。

三氯化磷和五氯化磷的物理常数如下:
熔点 | 沸点 | |
三氯化磷 | -112℃ | 76℃ |
五氯化磷 | 146℃ | 200℃分解 |
注:常温下五氯化磷不溶于三氯化磷
(1)写出A中发生反应的化学方程式:____________________________。
(2)反应开始前需要检查装置气密性,检查方法为____________________________。
(3)氯气和白磷反应放出大量的热,为使仪器D不致因局部过热而炸裂,实验开始前应在D的底部放少量____________________________。
(4)在烧杯E中加入冰盐水,其作用是____________________________。
(5)白磷与氯气反应产物中可能含有一定量的PCl5,从中分离出三氯化磷的方法是______________。经过一段时间反应发现B中竖直导管液面上开,可能的原因是____________________________。
(6)装置F的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知2C(s)+2O2(g)=2CO2(g) △H1; 2C(s)+O2(g)=2CO(g) △H2;,则△H1>△H2
D. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1NaOH 溶液分别滴定20.00mL 浓度均为0.10 mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下如图,关闭活塞,在左右两室(体积相同)各充入一定量H2和Cl2,且恰好使两容器内气体密度相同,打开活塞,点燃使H2与Cl2充分反应生成氯化氢气体:H2+Cl2=2HCl,恢复到原温度后,下列判断正确的是

A. 开始时左右两室分子数相同
B. 最终容器内无H2存在
C. 反应前后H2室压强相同
D. 最终容器内密度与原来相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_________________。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如下图装置进行研究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是_________。
②装置D的作用是____________________。
③当装置B、C、E、F依次出现下列现象:________________,品红褪色,______________,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。
结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2S2032-+I2=S4062-+2I-
(3)写出二氧化硫与碘水反应的化学方程式:___________________________。
(4)滴定终点的现象为:______________________。
(5)取蛋白质样品mg进行测定,采用C1mol/L的碘水V1mL进行吸收,滴定过量的碘时消耗C2mol/L硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为______________。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值___(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com