
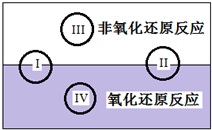
 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:分析 (1)发生的反应中含元素的化合价变化,为氧化还原反应;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应;
(3)Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒分析;
(4)P元素的化合价由+5价降低为0,以此计算转移电子.
解答 解:(1)A.煤的形成发生复杂的物理化学变化,C元素的化合价一定变化,为氧化还原反应,故A不选;
B.原电池工作为氧化还原反应原理的应用,故B不选;
C.简单机械织布,为物理变化,故C选;
D.烧制陶瓷发生复杂的物理化学变化,存在氧化过程,涉及氧化还原反应,如涉及碳的燃烧等,故D不选;
故答案为:C;
(2)由图可知,Ⅳ为氧化还原反应,且属于置换反应,如2Na+2H2O=2NaOH+H2↑,水中H元素的化合价降低,则水为氧化剂,
故答案为:2Na+2H2O=2NaOH+H2↑;是氧化剂;
(3)①Cu由+2价降低为0,N元素的化合价由-3价升高为0,由电子守恒、原子守恒可知,NH4Cl失去3个电子,而铜得到2个电子,得失电子守恒,NH4Cl前面系数为2,铜前面的系数为3,再结合原子守恒可知,反应为4CuO+2NH4Cl=3Cu+CuCl2+N2+4H2O,故答案为:4;2;3;1;1;4;
②N元素失去电子被氧化,Cu元素得到电子,则CuO为氧化剂,故答案为:氮;CuO;
③由反应可知,生成1mol气体转移6mol电子,则产生0.2mol的气体转移的电子为0.2mol×6=1.2mol,故答案为:1.2mol;
(4)P元素的化合价由+5价降低为0,每生成1mol P4时,转移电子为1mol×4×(5-0)=20mol,故答案为:20.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化铝溶液滴入浓氢氧化钠溶液中,立刻产生大量白色沉淀 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | A1Cl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 常温下,Al(OH)3既能与NaOH溶液反应又能与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com