
【题目】下列有关电化学装置的说法正确的是( )
A. 甲图装置可以实现铁片上镀锌
甲图装置可以实现铁片上镀锌
B. 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C. 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D.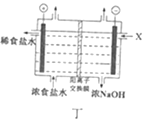 丁图中,X处补充稀NaOH溶液以增强溶液导电性
丁图中,X处补充稀NaOH溶液以增强溶液导电性
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物存在着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(g)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
①该反应的平衡常数表达式为:K=___;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___;
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态。
①___;②___。
(3)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___。
a.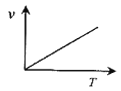 b.
b.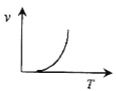
c.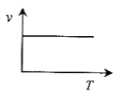 d.
d.
(4)写出氢氧化铝在水中发生酸式电离的电离方程式:___;欲使上述体系中Al3+浓度增加,可加入的物质是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应可表示获得乙醇并用作汽车燃料的过程,下列有关说法正确的是
①6CO2(g)+6H2O(l)=C6H12O6(s)+6O2(g) ΔH1
②C6H12O6(s)=2C2H5OH(l)+2CO2(g) ΔH2
③C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH3
A.2ΔH3=-ΔH1-ΔH2
B.在不同油耗汽车中发生反应③,ΔH3会不同
C.植物的光合作用通过反应①将热能转化为化学能
D.反应④C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH4,则ΔH3>ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是
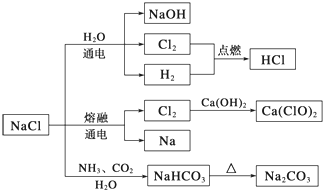
A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如图。
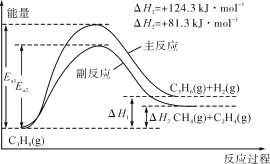
(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)__(填“增大”“减小”或“不变”,下同),转化率α(C3H8)__。
②温度升高,副反应更容易发生的主要原因是__。
(2)如图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105Pa)。
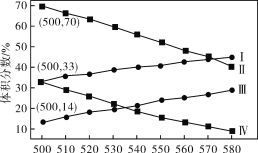
①104Pa时,图中表示丙烯的曲线是__(填“Ⅰ”“Ⅱ”“Ⅲ”或“Ⅳ”)。
②104Pa、500℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=__(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图。
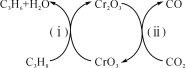
已知:CO和H2的燃烧热分别为-283.0kJ·mol-1、-285.8kJ·mol-1。
①图中催化剂为__。
②298K时,该工艺总反应的热化学方程式为__。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿物斜长石(主要成份为KAlSi3O8)在一定温度范围内用氯化钠熔浸可制得氯化钾,反应原理是NaCl(l)+KAlSi3O8(s)![]() KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯原子最外层的电子排布式___;氧原子核外电子的轨道式___;铝原子核外有___种不同能量的电子。
(2)上述反应涉及的元素中,原子半径最大的是___。该反应中位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,该元素是___;从原子结构方面去分析钠元素的金属性强于铝元素的原因是___。
(3)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行对照实验(保持其它条件不变),获得如下数据:
时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ― |
①分析以上数据可以得出,氯化钠熔浸钾长石是___(填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是___(选填编号)。
a.充分搅拌 b.延长反应时间
c.增大反应体系的压强 d.将钾长石粉粹成更小的颗粒
(2)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)![]() NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,该方法是否能说明钠比钾更活泼?___,(填“能说明”或“不能说明”)原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人工固氮最重要的途径,反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
(1)工业上有利于提高合成氨产率的条件有___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)关于合成氨的说法,正确的是__。
A.合成氨反应的ΔH和ΔS都小于零
B.控制在773K下反应,目的是加快反应速率和提高平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
(3)若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。

①比较p2、p3的大小:p2__p3(填“>”“<”或“=”),其原因是__。
②比较平衡时A、B点对应的化学反应速率:VA(N2)__VB(N2)(填“>”“<”或“=”)。
③若起始压强为1×108Pa,则平衡时B点的压强为___Pa。
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况).则原混合物中Na2O2和NaHCO3的物质的量之比为
A.8:1B.2:1C.3:2D.2:9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com