
【题目】下列说法正确的是
A. 32 g O2占的体积约为22.4 L
B. 1mol N2 含阿伏加德罗常数个氮原子
C. 在标准状况下,22.4 L H2O 的质量约为 18 g
D. 22 g CO2 与标准状况下11.2 L HCl 含有相同分子数
科目:高中化学 来源: 题型:
【题目】X,Y,Z三种短周期元素,它们的原子序数之和等于16,X2,Y2,Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:
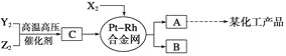
已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是___________________________________________;
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为________________________;
(3)化合物B吸收C后形成的溶液pH______7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示)___________________________________________________________________;
(4)写出由C生成A和B的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是

A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是
①混合物:氯水、氨水、水玻璃、水银、福尔马林、淀粉
②含有氧元素的化合物叫氧化物
③CO2、NO2、P2O5均为酸性氧化物,Al2O3、CaO2为碱性氧化物
④同素异形体:C60、C70、金刚石、石墨
⑤强电解质溶液的导电能力一定强
⑥在熔化状态下能导电的化合物为离子化合物
⑦有单质参加的反应或有单质生成的反应是氧化还原反应
A. 全部正确 B. ① ② ⑤ ⑦ C. ② ③ ⑥ D. ④ ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
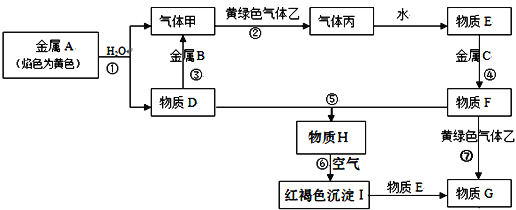
请回答下列问题:
(1)写出下列物质的化学式:B_________,丙_________,乙_________,H_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:_________________________________;
2)反应③离子方程式___________________________________________________;
3)反应⑦离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)反应2NO2(g) ![]() N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为_______________,B点时,设容器的总压为a Pa,则平衡常数Kp为____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③ 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________________________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com