
分析 在1L水中可溶解3xmol氯气,近似氯气难度为3xmol/L;依据平衡三段式列式计算得到平衡浓度:
Cl2+H2O?H++Cl-+HClO
起始浓度:3x 0 0 0
转化浓度:x x x x
平衡浓度:2x x x x
K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$=4.5×10-4,由此分析解答.
解答 解:在1L水中可溶解3xmol氯气,近似氯气难度为3xmol/L,则
Cl2+H2O?H++Cl-+HClO
起始浓度:3x 0 0 0
转化浓度:x x x x
平衡浓度:2x x x x
K=$\frac{c({H}^{+})•c(C{l}^{-})•c(HClO)}{c(C{l}_{2})}$=$\frac{{x}^{3}}{2x}$=4.5×10-4,x2=9×10-4,x=3×102,
所以Cl2的物质的量浓度为0.09mol/L,
故答案为:0.09mol/L.
点评 本题考查学生根据平衡常数表达式进行求平衡浓度,运用三行式求各物质的浓度,比较容易.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题

| A. | 该分子中有6个手性碳原子 | |
| B. | 它的分子式为C15H22O5 | |
| C. | 因其具有过氧基团,它不稳定,易受湿、热和还原性物质的影响而变质 | |
| D. | 它在常见有机溶剂中的溶解度大于在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉能漂白是因为Ca(ClO)2在一定条件下能生成HClO | |
| B. | 氢氧化铝、小苏打等可用于治疗胃酸过多 | |
| C. | 明矾能够消毒杀菌是利用了胶体的吸附性 | |
| D. | 二氧化硅可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g | B. | 9.6g | C. | 11.2g | D. | 12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 试剂 | 分离方法 |
| A | Cl2(水蒸气) | 生石灰 | 洗气 |
| B | KCl溶液(K2SO4) | 适量Ba(NO3)2溶液 | 过滤 |
| C | NaCl固体(KNO3) | 蒸馏水 | 冷却结晶 |
| D | 花生油(水) | - | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据上述热化学方程式可以确定H2、CH4的燃烧热 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H=-241.8kJ•mol-1 | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(g)△H>-890.31kJ•mol-1 | |
| D. | 8gCH4完全燃烧释放出的热量为445.155kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
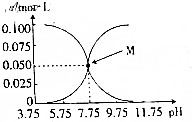 常温下,有c(HCN)+c(CN-)=0.1mol•L-1的氢氰酸、氰化钠的混合溶液,溶液中c(HCN)、c(CN-)与pH的关系如图所示,下列叙述错误的是( )
常温下,有c(HCN)+c(CN-)=0.1mol•L-1的氢氰酸、氰化钠的混合溶液,溶液中c(HCN)、c(CN-)与pH的关系如图所示,下列叙述错误的是( )| A. | 在pH=8.75的该溶液中:c(CN-)>c(HCN)>c(OH-)>c(H+) | |
| B. | 在M点所表示的溶液中:c(Na+)+c(H+)=c(HCN)+c(OH-) | |
| C. | 该溶液呈酸性、碱性或中性时,始终有:c(Na+)+c(H+)+c(OH-)-c(HCN)=0.1mol•L-1 | |
| D. | 该溶液中当c(HCN)=c(CN-)时,盐的水解程度大于酸的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,原因是二者可以发生双水解反应 | |
| B. | 电解精炼铜时,若阴极得到1.204×1024个电子,则阳极质量减少6.4g | |
| C. | 使甲基橙变红色溶液:Mg2+、K+、SO42-、NO3-能大量共存 | |
| D. | Na2S在空气中长期放置变浑浊的离子方程式为:2S2-+O2+4H+=2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com