
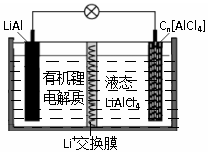
 某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )
某种新型电池的工作原理如图”所示.Cn为石墨烯,液态LiAlCl4中含有Li+和AlCl4-.下列说法正确的是( )| A. | 充电时,Cn为阳极,电极反应为:Cn+AlCl4--e-═Cn[AlCl4] | |
| B. | 放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向LiAl极移动 | |
| C. | LiAl具有强氧化性,放电时作负极材料 | |
| D. | 电池中可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故该电池存在安全隐患 |
分析 A、充电时,在阳极上发生失电子的氧化反应,据此回答;
B、在原电池中,电解质里的阳离子移向正极,阴离子移向负极;
C、在原电池的负极上具有还原性的物质失电子;
D、金属铝和水之间不会发生反应.
解答 解:A、充电时,电解池的正极和原电池的正极相连,在阳极上发生失电子的氧化反应Cn+AlCl4--e-═Cn[AlCl4],故A正确;
B、在原电池中,电解质里的阳离子移向正极,阴离子移向负极,放电时,当电路中通过0.1mol电子时,有0.1molLi+通过交换膜向Cn[AlCl4]极移动,故B错误;
C、在原电池的负极上具有还原性的物质失电子,LiAl具有还原性,放电时作负极材料,故C错误;
D、金属铝和水之间不会发生反应,所以电池中不可能发生副反应:2Al+6H2O═2Al(OH)3+3H2↑,故D错误.
故选A.
点评 本题考查了原电池和电解池原理,根据元素化合价变化确定各个电极上发生的反应,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用KI溶液除去FeCl2溶液中的Fe3+ | B. | 用饱和NaHCO3溶液除去Cl2中的HC1 | ||
| C. | 用金属钠鉴别1一丁醇和2一丁醇 | D. | 用溴水鉴别苯和己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
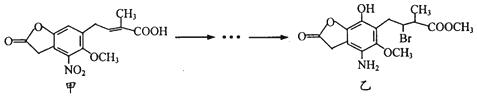
| A. | 甲的分子式为C14H14NO7 | |
| B. | 甲、乙中各有1个手性碳原子 | |
| C. | 可用NaHCO3溶液或FeCl3溶液鉴别化合物甲、乙 | |
| D. | 乙能与盐酸、NaOH溶液反应,且lmol乙最多能与4 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验步骤 | 实验现象 |
| ① | 将一小块金属钠放入滴有酚酞溶液的冷水中. | B |
| ② | 将磨去表面氧化膜的一小段镁条放入试管中,加入2mL水,滴入2滴酚酞溶液,加热至水沸腾. | D |
| ③ | 将磨去表面氧化膜的一小段镁条投入2mL 1mol/L盐酸中. | A |
| ④ | 将磨去表面氧化膜的一小片铝投入2mL 1mol/L盐酸中. | C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 乳酸分子[CH3-CH(OH)-COOH]中有 1 个手性碳且 1 mol 该分子中有 11 mol σ 键 | |
| C. | PCl5分子中P原子和Cl原子最外层都满足8电子结构 | |
| D. | H-O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
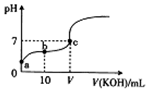 已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )
已知25℃时CH3COOH的电离常数K=1.6×10-5.该温度下向20ml 0.01mol•L-1 CH3COOH溶液中逐滴加入0.01mol•L-1 KOH溶液,其pH变化曲线如图所示(忽略温度变化),下列有关叙述正确的是 ( )| A. | a点溶液中c(H+)为4.0×10-5mol/L | |
| B. | c点溶液中的离子浓度大小顺序为c(K+)>c(CH3COO-)>c(H+)=c(OH-) | |
| C. | V=20 | |
| D. | a、b、c三点中水的电离程度最大的是c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨和金刚石完全燃烧,后者放热多 | |
| B. | 金刚石比石墨稳定 | |
| C. | 等量的金刚石储存的能量比石墨高 | |
| D. | 石墨很容易转化为金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 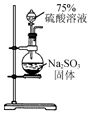 用装置制取二氧化硫 | B. | 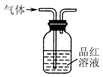 用装置检验二氧化硫的漂白性 | ||
| C. | 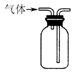 用装置收集二氧化硫 | D. | 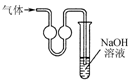 用装置进行尾气处理 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com