
| A. | 蔗糖 | B. | 二氧化硫 | C. | 水 | D. | 镁条 |
科目:高中化学 来源: 题型:解答题
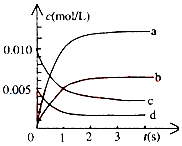 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
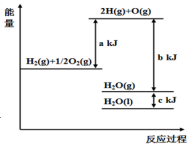
| A. | 1 mol H2(g)与$\frac{1}{2}$ mol O2(g)所具有的总能量比1 mol H2O(g)所具有的总能量高 | |
| B. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| C. | 2 mol H(g)与1 mol O(g)生成1 molH2O(g)所放出的热量是b kJ | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=2(b+c-a)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
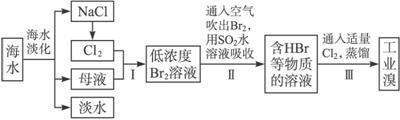
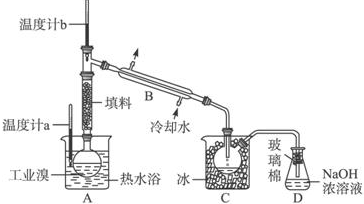
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
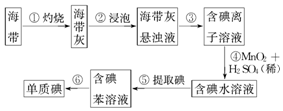
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com