
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是 ( )
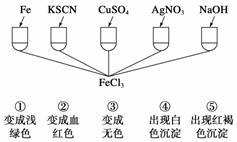
A.④ B.③ C.③④ D.①②③④⑤
科目:高中化学 来源: 题型:
下列关于官能团的引入、消除和转化的叙述不正确的是( )
A、烯烃的加成反应、卤代烃和酯的水解反应、醛酮的还原反应都可引入羟基
B、乙烯经过加成反应、消去反应可以得到乙炔
C、取代反应、加成反应和消去反应都可引入卤素原子
D、氧化反应、取代反应都可引入羧基
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A常用作烟道气的警告剂,也可以做橡胶硫化促进剂、鞣剂等。一定条件下它可发生下图转化。已知E为高分子化合物。
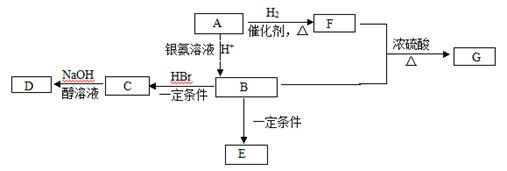
(1) 7.0 g有机物A完全燃烧可产生0.4 mol CO2和5.4 g H2O,经测定A分子含有甲基,所有的碳原子在一条碳链上,其蒸气对氢气的相对密度是35,A的结构简式为 。
(2)F中所含官能团的名称是 ,具有此官能团的F的同分异构体的数目有 种。
(3)B→C的反应类型为 ,C→D的反应类型为 。
(4)写出F+B→G的化学方程式 。
(5)下列关于B的说法正确的是 (填字母)。
A.不能使酸性高锰酸钾溶液褪色
B.可以与金属钠生成氢气
C.可以与碳酸钠反应
D.所有的原子都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
铁元素是典型的变价金属元素,它在化合物中主要表现为+2价和+3价,请归纳总结:
(1)Fe单质通常与哪些氧化剂反应生成 +2价?写出有关反应的化学方程式或离子方程式。
+2价?写出有关反应的化学方程式或离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物是中学化学中的一类重要物质,下列关于铁元素的叙述中正确的是( )
A.2Fe3++Fe===3Fe2+成立说明氧化性:Fe3+>Fe 2+
2+
B.25 ℃,pH=0的溶液中,Al3+、NH 、NO
、NO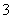 、Fe2+可以大量共存
、Fe2+可以大量共存
C.5.6 g铁与足量的氯气反应失去电子为0.2 mol
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
(1) H2(g)+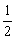 O2(g)= H2O(g);ΔH1= a kJ/mol
O2(g)= H2O(g);ΔH1= a kJ/mol
(2) 2H2(g)+O2(g)=2H2O(g);ΔH2= b kJ/mol
(3) H2(g)+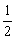 O2(g)=H2O(l);ΔH3= c kJ/mol
O2(g)=H2O(l);ΔH3= c kJ/mol
(4) 2H2(g)+O2(g)=2H2O(l);ΔH4= d kJ/mol
下列关系式正确的是:
A.a<c<0 B.b>d>0 C.2c=b>0 D.2c=d<0
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)太[b21] 阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的核外电子排布式 ▲ 。
(2)富勒烯衍生物由于具有良好的光电性能。富勒烯(C60)的结构如图1,分子中碳原子轨道的杂化类型为 ▲ ;1 mol C60分子中σ键的数目为 ▲ 。科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如图2所示。该化合物中的K原子和C60分子的个数比为 ▲ 。

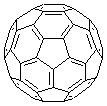
图1 图2
(3)砷化镓是人工合成的新型半导体材料,其晶体结构与金刚石相似。
①GaAs晶体中,每个As与 ▲ 个Ga相连。
②第一电离能:As ▲ Se(填“>”、“<”或“=”)。
(4)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ▲ ,与其互为等电子体的一种分子为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com