
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
分析 (1)根据元素守恒判断X的化学式;反应中化合价升高被氧化;
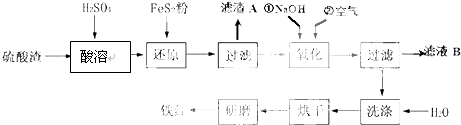
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
②根据得失电子守恒和原子守恒来配平,FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16;
③NaOH与Fe2+反应生成的氢氧化亚铁易被氧化;
④根据几种离子沉淀的pH分析;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠.
解答 解:(1)2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,根据元素守恒可知X的化学式为NaCl;反应中Fe(OH)3中的Fe元素是化合价升高被氧化,
故答案为:NaCl;Fe(OH)3;
(2)硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
①氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;SiO2;
②FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:8;2;16H+;
③Fe2+与OH-反应生成4Fe(OH)2,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,用化合价升价法配平方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓,
故答案为:4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓;
④根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:Al3+、Mg2+形成沉淀,使制得的铁红不纯;Na2SO4、Al2(SO4)3、MgSO4.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 叙述I | 叙述II |
| A | Fe3+的氧化性比Cu2+强 | FeCl3溶液可用于溶解回收旧电路板中的铜 |
| B | NH4Cl受热分解 | 加热可将Ca(OH)2和NH4Cl固体混合物分离 |
| C | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数为次外层电子数一半的短周期主族元素只有Li、Si两种元素 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间10个纵行的元素都是金属元素 | |
| C. | 同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25 | |
| D. | 若主族元素的族序数为a,周期数为b,当$\frac{a}{b}$<1,该元素为非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
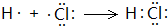
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com