
���и������뻯����֮��Ĺ�ϵ����ͼ�����ʼ�����������Ԫ�ؽ�Ϊ��
����Ԫ�أ���ش�
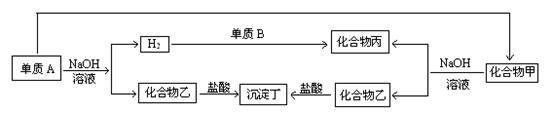 ��1���������������ڹ��������ᣬ ��Ϊ ����Ϊ ��
��1���������������ڹ��������ᣬ ��Ϊ ����Ϊ ��
�������������ڹ��������ᣬ��Ϊ ��
��2������Bһ����__________��д�����ĵ���ʽ�� ��
��3��д���йط�Ӧ����ʽ
�� �����������ڹ�������ʱ��д��A+NaOH�ķ�Ӧ��
�� �����������ڹ�������ʱ��д������������������ᷴӦ�ķ���ʽ��
��ÿ��2�֣���14�֣�
��1������SiO2 ����Na2SiO3
��Ϊ��Al��OH��3 (д����Ҳ��)
��2��O2 �����ĵ���ʽ��H�UO�UH
��3��Si +2NaOH +H2O == Na2SiO3 +2H2��
��4��AlO2-+4H+= Al3++2H2O ������û��ע����д���ӷ���ʽҲ�ɣ�
����ѧ֪ʶ��Χ������NaOH��Һ��Ӧ����H2�ĵ��ʿ�����Si Al Be Zn��,
���ӳ�������Ϥ�Ķ�����Ԫ��������Ӧ�ò����ҵ��𰸡�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 ���뼾���Ĵ���
���뼾���Ĵ��� �������ʵ���֮��2��1 ��Ӧʱ���ɻ��һ��������ȼ���м���X�����ͷų�һ���������壮�����Ĵ���X �ĺ˴Ź���������ͼ��ʾ��
�������ʵ���֮��2��1 ��Ӧʱ���ɻ��һ��������ȼ���м���X�����ͷų�һ���������壮�����Ĵ���X �ĺ˴Ź���������ͼ��ʾ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
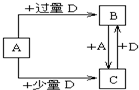 W��X��Y��Z��ԭ������������������ֶ�����Ԫ�أ���֪��W��һ��ԭ�ӵ�ԭ�Ӻ���û�����ӣ�Y��X���ڣ�Y��ZҲ���ڣ�X��Y��Z����Ԫ��ԭ�ӵ�����������֮��Ϊ3����������Ԫ��Z�ڵؿ��к�����ߣ��Իش����и��⣺
W��X��Y��Z��ԭ������������������ֶ�����Ԫ�أ���֪��W��һ��ԭ�ӵ�ԭ�Ӻ���û�����ӣ�Y��X���ڣ�Y��ZҲ���ڣ�X��Y��Z����Ԫ��ԭ�ӵ�����������֮��Ϊ3����������Ԫ��Z�ڵؿ��к�����ߣ��Իش����и��⣺| ŨH2SO4 |
| �� |
| ŨH2SO4 |
| �� |
| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ���� |
I | II | III | IV | V | VI | VII | 0 |
| 2 | �� | �� | ||||||
| 3 | �� | �� | �� | �� | �� | |||
| 4 | �� | �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
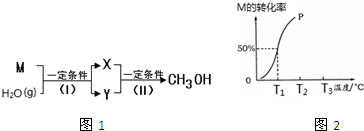
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com