
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | H2O2的电子式: | ||
| C. | 硫原子的结构示意图: | D. | 甲烷分子的比例模型: |
分析 A.中子数为20,则质量数为37,元素符号左上角的数字为质量数、左下角表示质子数;
B.双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合,不存在阴阳离子;
C.硫原子的核电荷数=核外电子总数=16,最外层为6个电子;
D.甲烷的比例模型主要体现C、H原子的相对体积大小及空间结构, 为甲烷的球棍模型.
为甲烷的球棍模型.
解答 解:A.氯元素的质子数为17,中子数为20的氯原子的质量数为37,该原子的正确表示方法为:${\;}_{17}^{37}$Cl,故A正确;
B.双氧水为共价化合物,分子中不存在阴阳离子,双氧水正确的电子式为: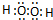 ,故B错误;
,故B错误;
C.硫原子的核电荷数、核外电子总数都是16,最外层为6个电子,硫原子正确的原子结构示意图为: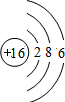 ,故C错误;
,故C错误;
D.甲烷为正面体结构,由原子相对大小表示空间结构为比例模型, 是甲烷的球棍模型,CH4分子正确的比例模型为:
是甲烷的球棍模型,CH4分子正确的比例模型为: ,故D错误;
,故D错误;
故选A.
点评 本题考查了常见化学用语的判断,题目难度中等,注意掌握电子式、原子结构示意图、比例模型与球棍模型、元素符号的表示方法,试题有利于题干学生规范答题的能力.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题
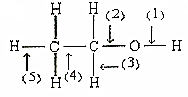 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者均属于离子化合物 | |
| B. | 两种化合物中所含有化学键类型相同 | |
| C. | Na3N与盐酸反应可得到2种盐 | |
| D. | Na3N中N3-半径比Na+半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式 | B. | 中子数为9的氧原子符号${\;}_{8}^{17}$O | ||
| C. | 氮分子的电子式 | D. | 钾离子的结构示意图  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物分子中不含有氧原子 | |
| B. | 该有机物分子中含一个氧原子 | |
| C. | 该有机物一个分子中含2个氧原子 | |
| D. | 不能确定该有机物分子中是否含有氧原子及其个数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com