
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。

请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。
(1)羧基 消去反应
(2)溴水
(3)CH3COOCH==CH2
(4)CH3CH2CH2COOH+HO—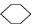
 CH3CH2CH2COO—
CH3CH2CH2COO— +H2O
+H2O
【解析】本题考查有机推断,要求熟练运用有机化合物的化学性质,思维敏捷。化学方程式书写要完整。A能发生银镜反应,产物H中有2个氧原子,说明A分子中只有一个—CHO,1 mol A与2 mol H2加成,可知A分子中还有一个碳碳双键。A为直链有机物,所以D为CH3CH2CH2COOH,E为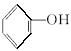 ,H为含碳碳双键的羧酸,结合酚、碳碳双键的性质分析可知,用溴水能鉴别D、E、H三
,H为含碳碳双键的羧酸,结合酚、碳碳双键的性质分析可知,用溴水能鉴别D、E、H三 种物质,产生白色沉淀的为E,能使溴水褪色的为H,第三种为D。J与H互为同分异构体,则J分子中有2个不饱和度,除酯基外还应有一个双键,故其结构简式为CH3COOCH==CH2。
种物质,产生白色沉淀的为E,能使溴水褪色的为H,第三种为D。J与H互为同分异构体,则J分子中有2个不饱和度,除酯基外还应有一个双键,故其结构简式为CH3COOCH==CH2。


科目:高中化学 来源: 题型:
为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2↑+O2↑ 2Cu(NO3)2
2KNO2↑+O2↑ 2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
 I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色②溶液变红色
I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色②溶液变红色
(1)则Fe(NO3)2分解的化学方程式是 。
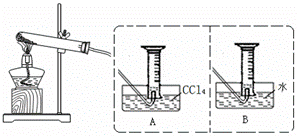
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)
实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是 。
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体___________mL。
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、 Cu(NO3)2、 Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、 Cu(NO3)2、 Fe(NO3)2物质的量之比可能为_____________。
A. 1∶2∶2 B. 2∶1∶3 C. 1∶2∶3 D. 3∶8∶5
(5)取0.6mol由KNO3、 Cu(NO3)2、 Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL 3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、Fe Cl3、CuCl2均不能采用将溶液直接蒸干的方法
Cl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液是阴极上依次析出Cu、Fe、Al
查看答案和解析>>
科目:高中化学 来源: 题型:
由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物,加入纯铁1mol并在高温下和Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
A.4:3 B.3:2 C.3:1 D.2:l
查看答案和解析>>
科目:高中化学 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验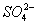 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验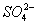 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
查看答案和解析>>
科目:高中化学 来源: 题型:
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如下图。反应中镁和铝的( )

A. 物质的量之比为3∶2
物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如下图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是
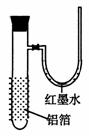
A 实验中发生的反应都是氧化还原反应
B 铝是一种较活泼的金属
C 铝与氧气反应放出大量的热量
D 铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下面关于电解质的叙述中错误的是( )
|
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 |
|
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 |
|
| C. | 电解质在水中一定能导电,在水中导电的化合物一定是电解质 |
|
| D. | BaSO4不溶于水,但BaSO4是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com