
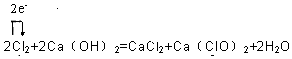 ,并用单线桥表示该反应电子转移的方向和数目.
,并用单线桥表示该反应电子转移的方向和数目. (任填一种物质的电子式)
(任填一种物质的电子式) 分析 (1)氯气在碱性溶液中自身发生氧化还原反应,生成氯化物和次氯酸盐,以此书写化学方程式;单线桥中由失去电子的元素指向得电子的元素,反应中转移电子数为2e-;
(2)次氯酸的酸性弱于碳酸,根据强酸制弱酸原理,漂白粉溶于水后,受空气中的CO2作用,生成CaCO3和HClO;
(3)一般来说,非金属元素之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键,注意金属元素和非金属元素之间可能形成共价键,据此分析解答.
解答 解:(1)氯气在碱性溶液中自身发生氧化还原反应,与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,Cl:0→-1,↓1,×2 Cl:0→+1,↑1,×2,用单线桥表示为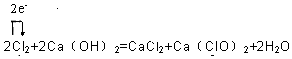 ,
,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(2)HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,漂粉精溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的某种物质为次氯酸,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(3)①Cl2为含有非极性共价键的单质,分子中氯原子和氯原子之间只存在共价键,结构式为Cl-Cl,H2S为只含有共价键的化合物,结构式为H-O-H,二氧化碳中只含共价键,结构式为O=C=O,
故答案为:Cl-Cl、H-O-H、O=C=O;
②氯化钙中氯离子和钙离子之间只存在离子键,其电子式中,两个氯离子不能合并,氯化钙的电子式为 ,
,
故答案为: .
.
点评 本题考查了氯气及其化合物的性质应用,主要考查化学方程式的书写和反应原理的理解以及化学键,注意相关知识的积累,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 物质的量是用来研究微观粒子的一个国际基本物理量,其单位处摩尔 | |
| B. | 气体的摩尔体积与温度和压强有关,压强越大,体积越大 | |
| C. | 若x个N (氮)原子的质级是1克,则阿伏加德罗常数可表示为14x/mol | |
| D. | 任何一种微观粒子,当摩尔质量以g/mol为单位时,其数值与这种粒子的相对分子质量或相对原子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
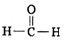 )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA| A. | ①④ | B. | ③④ | C. | ②⑥ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
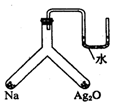 充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )
充分加热如图所示的密闭容器中放置有试剂的两个位置,若钠与氧化银均友应完且恢复到原来的温度时,U形管左右两侧液面相平,下列有关说法错误的是( )| A. | 装置内空气成分保持不变 | B. | 热稳定性:钠的氧化物强于Ag2O | ||
| C. | 装置内钠与Ag2O物质的量比为2:1 | D. | 有淡黄色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛的电子式: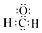 | |
| B. | 苯酚钠溶液中中通入少量二氧化碳气体: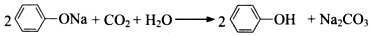 | |
| C. | 溴乙烷与氢氧化钠水溶液共热:C2H5Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| D. | 乙醇与灼热的氧化铜反应:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH碱溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 0.1mol•L-1Na2SO3溶液:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合溶液:$\frac{c{(HCO}_{3}^{-})}{c({H}_{2}C{O}_{3})}>$$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(CL-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L | B. | 5.6L | C. | 8.4L | D. | 14L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将pH=5的HCl 溶液稀释1000倍后pH变为8 | |
| B. | 将pH=8的NaOH溶液稀释1000倍后pH变为6 | |
| C. | 将 pH=2的HCl 溶液加热蒸发,体积变为原来的$\frac{1}{10}$,pH变为1 | |
| D. | 将pH=3的醋酸溶液稀释100倍后,pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 化学反应的限度不可以通过改变条件而改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com