
蛋白质的性质在生活中有许多实际应用.请在下表“性质”一栏中表述的蛋白质性质填空.
实例 | 性质 |
(1)紫外线消毒 | 变性 |
(2)蛋白质遇浓硝酸变黄 | |
(3)误食了重金属离子,可以立即喝大量的牛奶来缓解毒性 | |
(4)鸡蛋清溶液中加入少量饱和的硫酸铵溶液出现沉淀 | |
(5))常用酒精清洗伤口 | |
(6)蒸煮鸡蛋食用 |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:2017届河北省高三上10.6周测化学试卷(解析版) 题型:选择题
二元酸H2A在水中的电离情况是:H2A=H++HA-和HA- H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是
A.NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A)
B.NaHA:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+)
D.H2A:c(H+)=c(HA-)+2c(A2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上10月月考化学卷(解析版) 题型:选择题
在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g)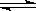 2NO(g)+O2(g)△H>0,下列叙述中正确的是
2NO(g)+O2(g)△H>0,下列叙述中正确的是
A.恒温恒容,充入NO2气体,其转化率增大
B.加压,平衡向逆反应方向移动,混合气体颜色变深
C.若平衡常数增大,则可能是升高了温度或减小了体系的压强
D.当2v正(NO)=v逆(O2)时,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学卷(解析版) 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 编号 | NaOH溶液 的浓度(mol/L) | 滴定完成时,消耗NaOH 溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.02 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.98 | 20.00 |
(1)滴定达到终点的现象是 ;此时锥形瓶内溶液的pH的范围是 。
(2)根据上述数据,可计算出该盐酸的浓度为 。
(3)排去碱式滴定管中气泡的方法应采用右图的 操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。


(4)右图是某次滴定时的滴定管中的液面,其读数为________mL。
(5)下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有 。
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数;
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省高二上9月月考化学卷(解析版) 题型:选择题
下列表示物质变化的化学用语正确的是( )
A.碳酸的电离H2CO3  2H++CO32-
2H++CO32-
B.氯化铁水解Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
C.硫氢化钠的水解HS-+H2O S2-+ H3O +
S2-+ H3O +
D.硫化铝固体在水中不存在Al2S3+6H2O Al(OH)3+3H2S
Al(OH)3+3H2S
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
下列过程没有发生化学反应的是( )
A.用活性炭去除冰箱中的异味
B.用热碱溶液清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保存水 果
果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次月考化学卷(解析版) 题型:选择题
能证明淀粉已经完全水解的试剂是( )
A.碘化钾溶液 B.银氨溶液 C.碘水 D.酚酞试剂
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上学期10月月考化学试卷(解析版) 题型:填空题
Ag/A12O3催化剂在工业上具有广泛用途。废银催化剂中银的回收既可节约资源,又有较好的经济效益。回收银的简化流程如下图所示(部分条件和试剂略):

请回答下列问题:
(1)第I步中,载体A12O3不与稀硝酸反应。Ag和稀硝酸反应产生的气体是____________。
(2)第II步中,饱和食盐水由工业食盐水提纯而得。除去工业食盐水中的少量Na2SO4、MgC12、CaC12杂质,正确的操作顺序是_________(填字母编号)。
a.加入稍过量的NaOH溶液
b.加入稍过量的BaC12溶液
c.过滤
d.加入稍过量的Na2CO3溶液
e.加入适量盐酸
(3)第III步中,加入氨水使沉淀溶解的离子方程式是____________ 。
(4)N2H4具有还原性,氧化产物为N2。第IV步反应的产物除Ag和N2外,还有的物质是_______(填化学式)。
(5)N2H4可用作火箭推进剂。已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g) △H = -534 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H = -116 kJ/mol
N2(g)+O2(g)=2NO(g) △H = +183 kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是______________________。
(6)Ag可制备银锌纽扣电池正极材料Ag2O,碱性条件下该电池的正极反应式是____。
(7)若上述流程中第I、II、III步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是________kg。
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上学期10月月考化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定大量共存的是
A.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
B.0.1mol/LNH4HCO3溶液中: K+、Na+、NO3-、Cl-
C.中性溶液中可能大量共存:Fe3+、K+、Cl-、SO42-
D.pH大于7的溶液:Na+、Ba2+、SO42-、 ClO--
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com