
下列离子方程式书写正确的是( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO +H2O
+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO +5NO
+5NO +6H+=2Mn2++5NO
+6H+=2Mn2++5NO +3H2O
+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO +Ba2++2OH-=BaCO3↓+2H2O+CO
+Ba2++2OH-=BaCO3↓+2H2O+CO
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2014年高考化学题型冲刺练习 化学基本概念、解决化学与STSE问题(解析版) 题型:选择题
民以食为天,下列处理食品的方法,不会危及人体健康的是( )
A.用甲醛浸泡海鲜 B.用二氧化硫漂白银耳
C.用干冰冷藏食品 D.用亚硝酸钠腌制咸肉
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是( )。
A.18 g H2O中含有的质子数为10NA
B.12 g金刚石中含有的共价键数为4NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:填空题
现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实验。实验过程和记录如图所示(无关物质已经略去):
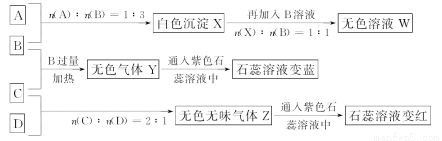
请回答:
(1)Y、Z的化学式分别为:Y________;Z__________。
X与B反应的离子方程式为_________________________________________________。
(2)D溶液pH________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)______________________________
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式________________________________
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是___________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
对水的电离平衡不产生影响的粒子是( )
A.HCl? B.26M3+
C. D.CH3COO-
D.CH3COO-
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1 160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:填空题
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
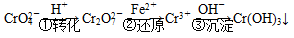
其中第①步存在平衡:
2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O 和CrO
和CrO 的浓度相同
的浓度相同
b.2v(Cr2O )=v(CrO
)=v(CrO )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
(5)用Fe做电极的原因为______________________________________
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________________,溶液中同时生成的沉淀还有________。
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
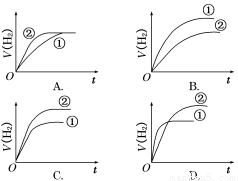
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com