
| A. | 甲醇可以使蛋白质变性,常用于食品保鲜 | |
| B. | 氧化铝熔点高,常用子制造耐火材枓 | |
| C. | 氧化钠可用作呼吸面具中的供氧剂 | |
| D. | 常温下,可用铁槽车或铝槽车运输稀硝酸 |
科目:高中化学 来源: 题型:解答题
 (一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式
(一)(1)化学式为C6Hm的烷烃,m值等于14;请写出HCl的电子式 .
.| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时通入空气的电极为负极 | |
| B. | 由于CO32-水解显碱性,电池放电时,电解质溶液的pH逐渐增大 | |
| C. | 电池放电时负极的电极反应式为CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 电池放电时每消耗1 mol CH3OH转移8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠投入到水中:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| B. | 氯化铵溶液与浓NaOH 溶液加热:NH4++OH-=NH3•H2O | |
| C. | 氯化铝溶液中滴入过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+ | |
| D. | 实验室制取氯气:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | |
| B. | 乙烯的电子式: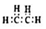 | |
| C. | 硫离子结构示意图: | |
| D. | 氢氧化钡的电离方程式:Ba(OH)2=Ba2++(OH-)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KMnO4是还原剂 | B. | HC1是氧化剂 | ||
| C. | HC1中的氯元素得到电子 | D. | KMnO4中的Mn元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在铜催化加热下可制得乙醚 | |
| B. | 淀粉在稀硫酸催化加热下可制得氨基酸 | |
| C. | 苯和乙烯在一定条件下反应可制得乙苯 | |
| D. | 乙苯与酸性高锰酸钾溶液反应生成苯乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
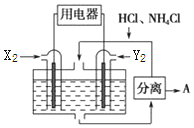 四种短周期元素X、Y、Z、W的部分信息如表:
四种短周期元素X、Y、Z、W的部分信息如表:| 元素 | 信息 |
| X | 原子半径最小 |
| Y | 单质在空气中含量最高 |
| Z | 其最外层电子数是电子层数的3倍 |
| W | 最高正价与最低负价的代数和为4 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com