
| 选项 | 混合物 | X | Y |
| ① | C3H6、C2H4 | m | 15m/7 |
| ② | HCHO、HCOOH | m | 15m/23 |
| ③ | CH3OH、CH3COOH | m | m |
| ④ | HCOOH、CH3COOCH3 | m | m |
| A. | ①② | B. | ③② | C. | ①③ | D. | ③④ |
分析 有机物在O2中完全燃烧生成CO2和H2O,燃烧后全部产物通过足量Na2O2层,2CO2+2Na2O2=2Na2CO3+O2,质量增重△m=2Na2CO3-2Na2O2=2CO,可知反应后固体质量增加量为CO的质量;Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m=2H2O-O2=2H2,可知反应后固体增加的质量为氢气质量,根据有机物的化学式和质量折合成CO和H2的质量,可确定过氧化钠的质量增重.
解答 解:有机物在O2中完全燃烧生成CO2和H2O,燃烧后全部产物通过足量Na2O2层,分别发生2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,过氧化钠的质量增重相当于CO和H2的质量,
①.C2H4~2CO+2H2,mg为乙烯时,过氧化钠的质量增重为$\frac{60}{28}$m=$\frac{15m}{7}$,C3H6与C2H4最简式相等,二者质量相等时,过氧化钠质量增重越相等,故过氧化钠的质量增重为$\frac{15m}{7}$,故①正确;
②.HCHO~CO+H2,mg为甲醛时,过氧化钠的质量增重为m,HCOOH~CO+H2,g为甲酸时,过氧化钠的质量增重为$\frac{30}{46}$=$\frac{15m}{23}$,故②错误;
③.CH3OH~CO+2H2,过氧化钠的质量增重为$\frac{32m}{32}$=m,CH3COOH~2CO+2H2,过氧化钠的质量增重为$\frac{60m}{60}$=m,无论以何种比例混合,过氧化钠的质量增重m,故③正确;
④.HCOOH~CO+H2,过氧化钠的质量增重为$\frac{30m}{46}$=$\frac{15m}{23}$,CH3COOCH3~3CO+3H2,过氧化钠的质量增重为$\frac{90m}{74}$,二者的物质的量关系不能确定,则质量增重不能确定,故④错误.
故选C.
点评 本题考查混合物有关计算,明确有机物燃烧产物与过氧化钠反应的质量增重关系为解答该题的关键,较好地考查学生分析计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 改用20mL 18mol/L的H2SO4实验 | B. | 反应物中加入少量的硝酸钠固体 | ||
| C. | 反应物中加入少量的硫酸铜固体 | D. | 反应物中加入少量的碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (取代反应)
(取代反应)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 3-甲基-1-丁炔 | ||
| C. | 2,3-二甲基-2-戊烯 | D. | 3,3-二乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不能干燥碱性气体NH3,也不可干燥CO、H2等还原性气体 | |
| B. | 常温下,铜片和浓硫酸反应产生的气体可使晶红溶液褪色 | |
| C. | 浓硫酸与磁性氧化铁的反应只表现出浓硫酸的酸性 | |
| D. | 蔗糖与浓硫酸的实验过程及现象表现出浓硫酸具有吸水性、脱水性和强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,C、D、E中原子半径最大的为Na.
,C、D、E中原子半径最大的为Na.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
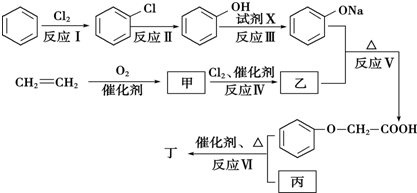
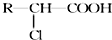
 .
.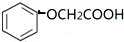 )有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有
)有多种属于酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上的一硝基取代物只有两种同分异构体的结构简式有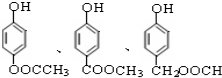 (其中两种)(任写两种即可).
(其中两种)(任写两种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
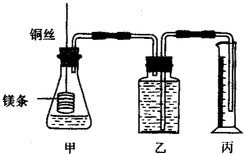 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com