
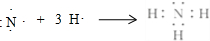 ;
;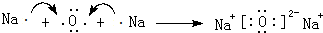 .
.分析 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,则F为Fe.
解答 解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,
(1)由H、N两种元素按原子数之比为3:1组成的物质甲为NH3,用电子式表示形成过程为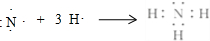 ,
,
由O、Na两种元素按原子个数比为1:2组成的物质乙为Na2O,用电子式表示形成过程为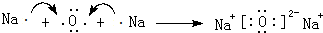 ,
,
故答案为: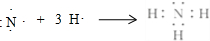 ;
;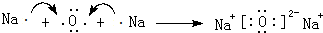 ;
;
(2)含Fe元素的黑色磁性氧化物为Fe3O4,与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)上述元素中H、N、O、S、Fe的五种元素可形成一种常见复盐,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,该盐含有SO42-,加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,该盐含有NH4+,经检测该复盐由三种离子组成且离子个数比为1:1:2,由电荷守恒可知,含有Fe3+,则该复盐的化学式为NH4Fe(SO4)2,
故答案为:NH4Fe(SO4)2;
(4)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,溶液中c(Ba2+)≈$\frac{0.06mol}{0.1L}$-0.1mol/L×2=0.4mol/L,该溶液中c(SO42-)×c(Ba2+)=2×10-9,故c(SO42-)=5×10-9mol/L,
故答案为:5×10-9mol/L.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,熟练掌握元素化合物知识,侧重考查学生对知识的迁移应用与分析解决问题的能力,难度中等.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:解答题
 ,与N3-互为等电子体的分子为N2O(写一种);
,与N3-互为等电子体的分子为N2O(写一种);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
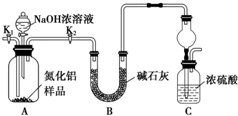
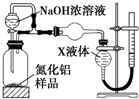
 d.NH4Cl溶液
d.NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
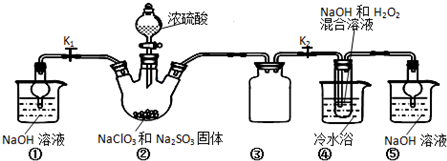
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.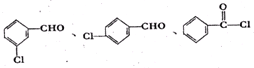 (不考虑立体异构).
(不考虑立体异构).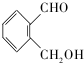 为有机原料制备化合物
为有机原料制备化合物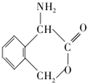 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).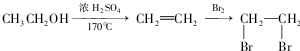 )
)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
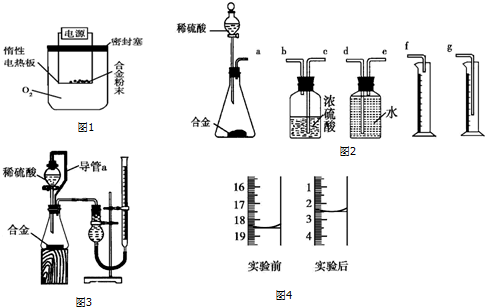
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com