
”¾ĢāÄæ”æÓÉĘĻĢŃĢĒ·¢½ĶæɵĆČéĖį£¬ĪŖŃŠ¾æČéĖįµÄ·Ö×Ó×é³ÉŗĶ½į¹¹£¬½ųŠŠĮĖĻĀŹöŹµŃé£ŗ
£Ø1£©³ĘČ”ČéĖį0.90g£¬ŌŚÄ³ÖÖדæöĻĀŹ¹ĘäĶźČ«Ęų»Æ£¬ĻąĶ¬×“æöĻĀĶ¬Ģå»żµÄH2µÄÖŹĮæĪŖ0.02g£¬ŌņČéĖįµÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ £®
£Ø2£©Čō½«ÉĻŹöČéĖįÕōĘųŌŚŃõĘųÖŠČ¼ÉÕֻɜ³ÉCO2ŗĶH2O£Øg£©£¬µ±Č«²æ±»¼īŹÆ»ŅĪüŹÕŹ±£¬¼īŹÆ»ŅµÄÖŹĮæŌö¼Ó1.86g£»Čō½«“Ė²śĪļĶØČė¹żĮæŹÆ»ŅĖ®ÖŠ£¬Ōņ²śÉś3.00g°×É«³Įµķ£®ŌņČéĖįµÄ·Ö×ÓŹ½ĪŖ £®
£Ø3£©ĮķČ”0.90gČéĖį£¬ČōÓė×ćĮ潚ŹōÄĘ·“Ó¦£¬Éś³ÉH2224mL£Ø±ź×¼×“æö£©£¬ČōÓė×ćĮæĢ¼ĖįĒāÄĘ·“Ó¦£¬Éś³É224mLCO2£Ø±ź×¼×“æö£©£¬ŌņČéĖįµÄ½į¹¹¼ņŹ½æÉÄÜĪŖ»ņ £®
£Ø4£©ČōĘĻĢŃĢĒ·¢½Ķֻɜ³ÉČéĖį£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ £®
£Ø5£©ČéĖįÓėŅŅĖį”¢ČéĖįÓėŅŅ“¼¾łÄÜ·¢Éśõ„»Æ·“Ó¦£¬ĻąĶ¬ÖŹĮæČéĖįĖłÉś³ÉµÄĮ½ÖÖõ„»Æ²śĪļ£ØÓŠ»śĪļ£©µÄÖŹĮæ±ČĪŖ £®
”¾“š°ø”æ
£Ø1£©90
£Ø2£©C3H6O3
£Ø3£©CH2£ØOH£©CH2COOH£»![]()
£Ø4£©C6H12O6 ![]() 2CH3CH£ØOH£©COOH
2CH3CH£ØOH£©COOH
£Ø5£©66£ŗ59
”¾½āĪö”æ½ā£ŗ£Ø1£©Ļą¶Ō·Ö×ÓÖŹĮæÖ®±ČµČÓŚĆܶČÖ®±Č£¬ŌņMr£ØČéĖį£©£ŗ2=0.9g£ŗ0.02g£¬¹ŹMr£ØČéĖį£©=90£¬¹Ź“š°øĪŖ£ŗ90£»£Ø2£©3.00g°×É«³ĮµķĪŖĢ¼ĖįøĘ£¬ĪļÖŹµÄĮæĪŖ ![]() =0.03mol£¬ČéĖįµÄĪļÖŹµÄĮæĪŖ
=0.03mol£¬ČéĖįµÄĪļÖŹµÄĮæĪŖ ![]() =0.01mol£¬0.01molČéĖįĶźČ«Č¼ÉÕÉś³ÉCO2 0.03 mol£¬ŌņČéĖį·Ö×ÓÖŠCŌ×ÓŹżÄæĪŖ
=0.01mol£¬0.01molČéĖįĶźČ«Č¼ÉÕÉś³ÉCO2 0.03 mol£¬ŌņČéĖį·Ö×ÓÖŠCŌ×ÓŹżÄæĪŖ ![]() =3£¬Éś³ÉH2OµÄÖŹĮæ=1.86g©0.03mol”Į44g/mol=0.54g£¬ĘäĪļÖŹµÄĮæĪŖ0.03 mol£¬ČéĖį·Ö×ÓÖŠHŌ×ÓŹżÄæĪŖ
=3£¬Éś³ÉH2OµÄÖŹĮæ=1.86g©0.03mol”Į44g/mol=0.54g£¬ĘäĪļÖŹµÄĮæĪŖ0.03 mol£¬ČéĖį·Ö×ÓÖŠHŌ×ÓŹżÄæĪŖ ![]() =6£¬ŌņČéĖį·Ö×ÓÖŠOŌ×ÓŹżÄæĪŖ
=6£¬ŌņČéĖį·Ö×ÓÖŠOŌ×ÓŹżÄæĪŖ ![]() =3£¬ĖłŅŌČéĖįµÄ·Ö×ÓŹ½ĪŖC3H6O3 £¬
=3£¬ĖłŅŌČéĖįµÄ·Ö×ÓŹ½ĪŖC3H6O3 £¬
¹Ź“š°øĪŖ£ŗC3H6O3£»£Ø3£©ČéĖįµÄĪļÖŹµÄĮæĪŖ ![]() =0.01mol£¬ÓėĢ¼ĖįÄĘ·“Ӧɜ³É¶žŃõ»ÆĢ¼ĪŖ
=0.01mol£¬ÓėĢ¼ĖįÄĘ·“Ӧɜ³É¶žŃõ»ÆĢ¼ĪŖ ![]() =0.005mol£¬ÓÉÓŚ2©COOH”«CO2”ü£¬ŌņČéĖį·Ö×Óŗ¬ÓŠ1øö©COOH£¬ÓėÄĘ·“Ӧɜ³ÉĒāĘųĪŖ
=0.005mol£¬ÓÉÓŚ2©COOH”«CO2”ü£¬ŌņČéĖį·Ö×Óŗ¬ÓŠ1øö©COOH£¬ÓėÄĘ·“Ӧɜ³ÉĒāĘųĪŖ ![]() =0.01mol£¬2©COOH”«H2”ü£¬2©OH”«H2”ü£¬æÉÖŖČéĖį·Ö×Ó»¹ŗ¬ÓŠŅ»øö©OH£¬æÉÖŖČéĖįµÄ½į¹¹¼ņŹ½æÉÄÜŹĒCH2£ØOH£©CH2COOH£»
=0.01mol£¬2©COOH”«H2”ü£¬2©OH”«H2”ü£¬æÉÖŖČéĖį·Ö×Ó»¹ŗ¬ÓŠŅ»øö©OH£¬æÉÖŖČéĖįµÄ½į¹¹¼ņŹ½æÉÄÜŹĒCH2£ØOH£©CH2COOH£» ![]() £¬
£¬
¹Ź“š°øĪŖ£ŗCH2£ØOH£©CH2COOH£» ![]() £»£Ø4£©ČōĘĻĢŃĢĒ·¢½Ķֻɜ³ÉČéĖį£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗC6H12O6
£»£Ø4£©ČōĘĻĢŃĢĒ·¢½Ķֻɜ³ÉČéĖį£¬Ęä·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗC6H12O6 ![]() 2CH3CH£ØOH£©COOH»ņC6H12O6 £ØĘĻĢŃĢĒ£©£»
2CH3CH£ØOH£©COOH»ņC6H12O6 £ØĘĻĢŃĢĒ£©£»
¹Ź“š°øĪŖ£ŗC6H12O6 ![]() 2CH3CH£ØOH£©COOH£»£Ø5£©ŅŅĖįÓėČéĖįÉś³ÉµÄõ„µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ60+90©18=132£»ČéĖįÓėŅŅ“¼Éś³ÉµÄõ„µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ46+90©18=118£¬ĻąĶ¬ÖŹĮæČéĖįĖłÉś³ÉµÄĮ½ÖÖõ„»Æ²śĪļ£ØÓŠ»śĪļ£©µÄÖŹĮæ±ČĪŖ£ŗ132£ŗ118=66£ŗ59£¬
2CH3CH£ØOH£©COOH£»£Ø5£©ŅŅĖįÓėČéĖįÉś³ÉµÄõ„µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ60+90©18=132£»ČéĖįÓėŅŅ“¼Éś³ÉµÄõ„µÄĻą¶Ō·Ö×ÓÖŹĮæĪŖ46+90©18=118£¬ĻąĶ¬ÖŹĮæČéĖįĖłÉś³ÉµÄĮ½ÖÖõ„»Æ²śĪļ£ØÓŠ»śĪļ£©µÄÖŹĮæ±ČĪŖ£ŗ132£ŗ118=66£ŗ59£¬
¹Ź“š°øĪŖ£ŗ66£ŗ59£®
£Ø1£©Ļą¶Ō·Ö×ÓÖŹĮæÖ®±ČµČÓŚĘäĆܶČÖ®±Č£»£Ø2£©3.00g°×É«³ĮµķĪŖĢ¼ĖįøĘ£¬¼īŹÆ»ŅŌöÖŲĪŖČéĖįÉś³É¶žŃõ»ÆĢ¼ÓėĖ®µÄ×ÜÖŹĮ棬¼ĘĖ涞Ńõ»ÆĢ¼”¢ČéĖįµÄĪļÖŹµÄĮ棬½ų¶ų¼ĘĖćČ¼ÉÕÉś³ÉĖ®µÄÖŹĮ棬øł¾ŻŌ×ÓŹŲŗć¼ĘĖć·Ö×ÓÖŠC”¢HŌ×ÓŹżÄ棬ŌŁøł¾ŻĻą¶Ō·Ö×ÓÖŹĮæ¼ĘĖćOŌ×ÓŹżÄ棬½ų¶ųČ·¶Ø·Ö×ÓŹ½£»£Ø3£©ČéĖįĪŖ0.01mol£¬ÓėĢ¼ĖįÄĘ·“Ӧɜ³É¶žŃõ»ÆĢ¼ĪŖ0.005mol¶žŃõ»ÆĢ¼£¬ĖµĆ÷ČéĖį·Ö×Óŗ¬ÓŠ1øö©COOH£¬ÓėÄĘ·“Ӧɜ³É0.01molĒāĘų£¬ŌņĖµĆ÷»¹ŗ¬ÓŠŅ»øö©OH£¬½įŗĻ·Ö×ÓŹ½ŹéŠ“æÉÄܵĽį¹¹¼ņŹ½£»£Ø4£©½įŗĻ£Ø3£©ÖŠČéĖįµÄæÉÄܽį¹¹ŹéŠ“·½³ĢŹ½£»£Ø5£©ĻąĶ¬ÖŹĮæČéĖįĖłÉś³ÉµÄĮ½ÖÖõ„»Æ²śĪļ£ØÓŠ»śĪļ£©µÄÖŹĮæ±ČµČÓŚĮ½ÖÖ²śĪļµÄĦ¶ūÖŹĮæÖ®±Č£®


 ŠÄĖćæŚĖćĒÉĖćŅ»æĪŅ»Į·ĻµĮŠ“š°ø
ŠÄĖćæŚĖćĒÉĖćŅ»æĪŅ»Į·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æµŖµÄ¹Ģ¶ØÖ÷ŅŖÓŠČż“óĶ¾¾¶£¬ĖüĆĒŹĒ_______”¢_______”¢_______£»µŖ·ŹÖ÷ŅŖÓŠ_______”¢ĻõĢ¬µŖ·ŹŗĶ_______£¬ÄæĒ°µŖ·ŹÖŠŹ¹ÓĆĮæ×ī¶ąµÄŅ»ÖÖ·ŹĮĻŹĒ_______£»ŗ¬_______ČżŅŖĖŲÖŠµÄĮ½ÖÖ»ņĮ½ÖÖŅŌÉĻµÄ»Æѧ·ŹĮĻ³Ęø“ŗĻ·ŹĮĻ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¹ŲŅŅĻ©µÄĻĀĮŠŠšŹöÕżČ·µÄŹĒ
¢ŁŅŅĻ©ČÜÓŚĖ®ŗóæɵĆŅŅ“¼ ¢ŚŅŅĻ©·¢Éś¼Ó¾Ū·“Ӧɜ³É¾ŪŅŅĻ© ¢ŪŅŅĶéÖŠ»ģÓŠŅŅĻ©æÉÓĆäåĖ®Ļ“Ęų³żČ„””¢ÜŅŅĻ©ŹĒĪŽÉ«”¢ÉŌÓŠĘųĪ¶”¢ÄŃČÜÓŚĖ®µÄĘųĢå
A. ÓŠ¢Ś B. ¢ŁŗĶ¢Ū C. ¢ŚŗĶ¢Ū D. ¢Ś¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹČŪ»ÆŹ±£¬²»ĘĘ»µ»Æѧ¼üµÄŹĒ( )
A.ĀČ»ÆÄĘB.Ė®¾§C.½šøÕŹÆD.Ź®ĘßĶé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. Ōµē³ŲŹĒ°ŃµēÄÜ×Ŗ»ÆĪŖ»ÆѧÄܵÄ×°ÖĆ B. »Æѧ·“Ó¦ÖŠÄÜĮæ±ä»ÆµÄ“óŠ”Óė·“Ó¦ĪļµÄÖŹĮæ¶ąÉŁĪŽ¹Ų
C. ŌŖĖŲÖÜĘŚ±ķÖŠµŚ¢ńA×åČ«²æŹĒ½šŹōŌŖĖŲ D. Ōµē³ŲÖŠµÄŃōĄė×ÓĻņÕż¼«ŅʶÆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÓĆĶ¼Ź¾×°ÖĆÖʱøKC1OČÜŅŗ£¬ŌŁÓėKOH”¢Fe(NO3)3ČÜŅŗ·“Ó¦Öʱøó{Š§¾»Ė®¼ĮK2FeO4”£

<ĖŌÄ׏ĮĻ>O2ÓėKOHČÜŅŗŌŚ20”ęŅŌĻĀ·“Ӧɜ³ÉKC1O£¬ŌŚ½ĻøßĪĀ¶ČĻĀŌņÉś³ÉKC1O3£»K2FeO4Ņ×ČÜÓŚĖ®£¬Ī¢ČÜÓŚÅØKOHČÜŅŗ£¬ŌŚ0”ꔫ5”ęµÄĒæ¼īŠŌČÜŅŗÖŠ½ĻĪČ¶Ø”£
(1)ŅĒĘ÷aµÄĆū³ĘŹĒ___________£»×°ÖĆAÖŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ___________________”£
×°ÖĆCÖŠČż¾±ÉÕĘæÖĆÓŚ±łĖ®Ō”ÖŠµÄÄæµÄŹĒ_______________”£
(2)×°ÖĆBĪüŹÕµÄĘųĢåŹĒ___________£¬×°ÖĆDµÄ×÷ÓĆŹĒ____________________”£
(3)CÖŠµĆµ½×ćĮæKC1Oŗ󣬽«Čż¾±ÉÕĘæÉĻµÄµ¼¹ÜČ”ĻĀ£¬ŅĄ“Ī¼ÓČėKOHČÜŅŗ”¢Fe(NO3)3ČÜŅŗ£¬Ė®Ō”æŲÖĘ·“Ó¦ĪĀ¶ČĪŖ25”ę£¬½Į°č1.5 h£¬ČÜŅŗ±äĪŖ×ĻŗģÉ«(ŗ¬K2FeO4)£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ________________”£ŌŁ¼ÓČė±„ŗĶKOHČÜŅŗ£¬ĄäČ“ÖĮ0”ꔫ5”ęĪö³ö×ĻŗŚÉ«¾§Ģ壬¹żĀĖ£¬µĆµ½K2FeO4“Ö²śĘ·”£
(4)K2FeO4“Ö²śĘ·ŗ¬ÓŠFe(OH)3”¢KC1µČŌÓÖŹ£¬ĘäĢį“æ²½ÖčĪŖ£ŗ
¢Ł½«Ņ»¶ØĮæµÄK2FeO4“Ö²śĘ·ČÜÓŚĄäµÄ3 mol/LKOHČÜŅŗÖŠ”£
¢Ś¹żĀĖ”£
¢Ū____________________”£
¢Ü½Į°č”¢¾²ÖĆ”¢¹żĀĖ£¬ÓĆŅŅ“¼Ļ“µÓ2”«3“Ī£¬
¢ŻŌŚÕęæÕøÉŌļĻäÖŠøÉŌļ”£
(5)³ĘČ”Ģį“æŗóµÄK2FeO4ѳʷ0.2200 gÓŚÉÕ±ÖŠ£¬¼ÓČėĒæ¼īŠŌNaCr(OH)ČÜŅŗ£¬·“Ó¦ŗóŌŁ¼ÓĻ”H2SO4µ÷½ŚČÜŅŗ³ŹĒæĖįŠŌ£¬Åä³É250 mLČÜŅŗ£¬Č”³ö25.00 mL·ÅČė׶ŠĪĘ棬ÓĆ0.01000 mol/LµÄ(NH4)2Fe(SO4)2ČÜŅŗµĪ¶ØÖĮÖÕµć£¬ÖŲø“²Ł×÷2“Ī£¬Ę½¾łĻūŗÄ(NH4)2Fe(SO4)2ČÜŅŗ30.00 mL”£Éę¼°Ö÷ŅŖ·“Ó¦ĪŖ£ŗ
Cr(OH)4-+FeO42- =Fe(OH)3”ż+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
ŌņøĆK2FeO4ѳʷµÄ“æ¶ČĪŖ_________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆĢĖįļ®(LiMn2O4)æÉ×÷ĪŖļ®Ąė×Óµē³ŲµÄÕż¼«²ÄĮĻ”£¹¤ŅµÉĻĄūÓĆČķĆĢæó½¬ĪüŹÕŗ¬ĮņŃĢĘų£ØSO2 ŗĶO2£©ÖʱøĆĢĖįļ®£¬Éś²śĮ÷³ĢČēĻĀ£ŗ
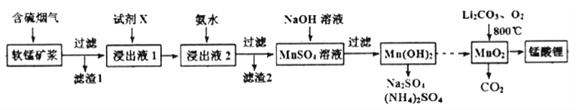
ŅŃÖŖ£ŗ¢ŁČķĆĢæóÖ÷ŅŖ³É·ÖĪŖMnO2£¬ŗ¬ÉŁĮæFe2O3”¢FeO”¢Al2O3”¢SiO2µČŌÓÖŹ”£
¢ŚČķĆĢæó½¬ŌŚĪüŹÕŗ¬ĮņŃĢĘųµÄ¹ż³ĢÖŠĖįŠŌÖš½„ŌöĒ攣
¢Ū²æ·ÖĒāŃõ»ÆĪļ³ĮµķĻą¹ŲµÄČÜŅŗpHČēĻĀ±ķ£ŗ
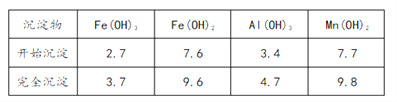
£Ø1£©ŅŃÖŖ£ŗ
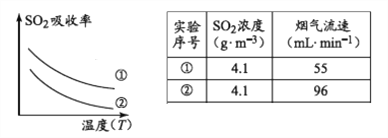
ĻĀĮŠ“ėŹ©æÉĢįøßSO2ĪüŹÕĀŹµÄŹĒ__________£ØĢīŠņŗÅ£©
a.½µµĶĶØČėŗ¬ĮņŃĢĘųµÄĪĀ¶Č b.ÉżøßĶØČėŗ¬ĮņŃĢĘųµÄĪĀ¶Č
c.¼õÉŁČķĆĢæ󽬵ĽųČėĮæ d.¼õŠ”ĶØČėŗ¬ĮņŃĢĘųµÄĮ÷ĖŁ
£Ø2£©¼ÓČėŹŌ¼ĮXÄÜĢįøß²śĘ·“æ¶Č£¬ŌņXæÉŅŌŹĒ_____________£ØĢī»ÆѧŹ½£©
£Ø3£©¼Ó°±Ė®µ÷ČÜŅŗpHŌŚ5”«6Ö®¼ä£¬ÄæµÄŹĒ_______________”£
£Ø4£©ĆĢĖįļ®æɳäµēµē³ŲµÄ×Ü·“Ó¦Ź½ĪŖ£ŗLi1-xMnO2+LixC ![]() LiMn2O4+C(x<1)
LiMn2O4+C(x<1)
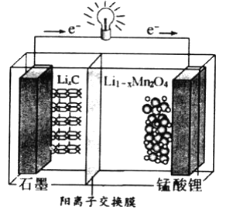
¢Ł·ÅµēŹ±£¬µē³ŲµÄÕż¼«·“Ó¦Ź½ĪŖ__________________
¢Ś³äµēŹ±£¬Čō×ŖŅĘ1mole-£¬ŌņŹÆÄ«µē¼«½«ŌöÖŲ__________g”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ£Ø £©
A.Óė28 gCO¾ßÓŠĻąĶ¬·Ö×ÓŹżµÄC2H4µÄÖŹĮæŅ»¶ØŹĒ28 g
B.1 molAl 3+ŗ¬ÓŠµÄŗĖĶāµē×ÓŹżĪŖ3NA
C.³£ĪĀ³£Ń¹ĻĀ£¬1 mol¼×Ķéŗ¬ÓŠµÄŌ×ÓŹżĪŖ5NA
D.³£ĪĀ³£Ń¹ĻĀ£¬1 molLĒāĘųµÄĢå»ż“óÓŚ22.4 L
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“ÓijŠ©ŠŌÖŹæ“£¬NH3ŗĶH2O£¬NH4 +ŗĶH3O+£¬OH-ŗĶNH2-£¬N3”ŖŗĶO2”ŖĮ½Į½ĻąĖĘ£¬¾Ż“ĖÅŠ¶ĻĻĀĮŠ·“Ó¦Ź½ÖŠ²»ÕżČ·µÄŹĒ
A. 2Na+2NH3===2NaNH2+H2ӟ
B. 3CaO+4NH4Cl===Ca3N2+2NH3ӟ+3H2O+4HCl
C. 3Mg(NH2)2![]() Mg3N2+4NH3ӟ
Mg3N2+4NH3ӟ
D. NH4Cl+NaNH2===NaCl+2NH3ӟ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com