
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
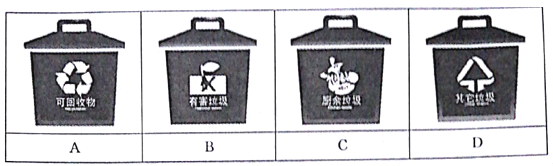
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
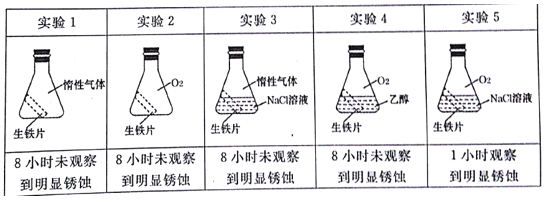
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
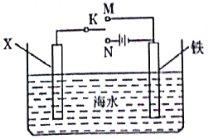
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
【答案】B A 有氧气和电解质溶液 O2+2H2O+4e-=4OH- 电极材料X可为锌棒,并将开关K置于M处 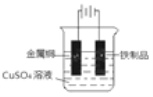 3Fe-8e-+4H2O=Fe3O4+8H+
3Fe-8e-+4H2O=Fe3O4+8H+
【解析】
(1)其中镍镉电池和汽水易拉罐分别属于有害垃圾和可回收垃圾,分别投入B和A垃圾桶中。
(2)从图中对比可知金属腐蚀的条件是有氧气和电解质溶液,5得电子的反应过程O2+2H2O+4e-=4OH-。
(3)若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X可为锌棒,并将开关K置于M处 。
(4)在铁制品上镀铜时铁制品作阴极,铜作阳极,硫酸铜作电解质,则实验装置示意图为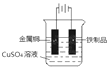 。
。
(5)将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,阳极的电极反应式3Fe-8e-+4H2O=Fe3O4+8H+。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某有机物A能与NaOH溶液反应,其分子中含有苯环,相对分子质量为136,其中含碳的质量分数为70.6%,氢的质量分数为5.9%,其余为氧。
(1)A的分子式是_________。
若A能与NaHCO3溶液反应放出CO2气体,其结构有_____种。
(3)若A与NaOH溶液在加热时才能反应,且1mol A消耗1mol NaOH,则A的结构简式可能是___________________或者是_______________________。
(4)若A与NaOH溶液在加热时才能反应,且1mol A消耗2mol NaOH,则符合条件的A的结构可能有____种,其中能发生银镜反应的有____种,不能发生银镜反应的物质的结构简式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验:
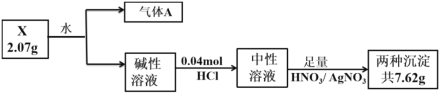
已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)X中非金属元素的名称为__________,X的化学式__________。
(2)X与水反应的化学方程式为_________。
(3)化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型__________。
(4)补充焰色反应的操作:取一根铂丝,________,蘸取待测液灼烧,观察火焰颜色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加入铝粉能放出氢气的溶液:Na+、Mg2+、Cl-、NO3-;
B.由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Fe2+、NH4+、ClO-、SO42-
C.![]() =1.0×10-12的溶液:K+、SO32-、S2-、Cl-
=1.0×10-12的溶液:K+、SO32-、S2-、Cl-
D.c(NH4+)=c(Cl-)的NH4Cl-NH3·H2O混合液:Al3+、Fe3+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学化学反应原理,解决以下问题:
(1)请用离子方程式表示泡沫灭火器的工作原理___。
(2)请用离子方程式解释漂白粉和洁厕灵不能混合使用的原因___。
(3)难溶物ZnS可作为沉淀剂除去废水中的Cu2+,写出该过程的离子方程式___。
(4)用CO(g)还原80gFe2O3(s)生成Fe(s)和CO2(g),放热12.4kJ,请写出该反应的热化学方程式___。
(5)已知2CO(g)![]() CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
CO2(g)+C(s),T=980K时,△H-T△S=0。在冶金工业中,以C为还原剂,温度高于980K时,C的氧化产物主要是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.S(g)+O2(g)=SO2(g) △H1, S(s)+O2(g)=SO2(g) △H2;则:△H1>△H2。
B.由C(石墨)=C(金刚石) ΔH=+119kJ·mol-1可知,金刚石比石墨稳定。
C.在稀溶液中:H+(aq)+OH-(aq) ===H2O(l);ΔH=-57.3kJ·mol-1,若将含1mol CH3COOH的稀溶液与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ。
D.在101kPa、25℃时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g) ===2H2O(l);ΔH=-571.6kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做了如下4个实验:
①在铝盐溶液中逐滴加入稀氨水直至过量;
②在明矾溶液中加入氢氧化钡溶液直至过量;
③在含少量氢氧化钠的偏铝酸钠溶液中通入二氧化碳直至过量;
④在少量盐酸的氯化铝溶液中加入氢氧化钠至过量。
在4个图像,纵坐标为沉淀物质的量,横坐标为溶液中加入物质的物质的量,上述实验与图像对应关系正确的是( )
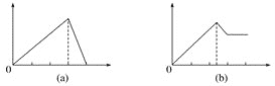
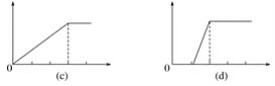
A.①-(d)B.②-(b)C.③-(c)D.④-(a)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com