
| A. | 用加热法除去NaOH固体中混有的NH4Cl固体. | |
| B. | 向Al2(SO4)3溶液中滴加过量的NaOH溶液制备Al(OH)3 | |
| C. | SO2能使酸性KMnO4溶液褪色,说明SO2具有漂白性 | |
| D. | 向水玻璃中滴加盐酸制备硅酸 |
分析 A.加热时氯化铵与NaOH反应;
B.滴加过量的NaOH溶液反应生成偏铝酸钠、硫酸钠;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应;
D.水玻璃中滴加盐酸,发生强酸制取弱酸的反应生成硅酸.
解答 解:A.加热时氯化铵与NaOH反应,则加热法不能除杂,故A错误;
B.滴加过量的NaOH溶液反应生成偏铝酸钠、硫酸钠,应利用硫酸铝与氨水反应制备,故B错误;
C.SO2能使酸性KMnO4溶液褪色,发生氧化还原反应,说明二氧化硫具有还原性,与漂白无关,故C错误;
D.盐酸的酸性大于硅酸,水玻璃中滴加盐酸,发生强酸制取弱酸的反应生成硅酸,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 | |
| B. | 浓硫酸可用作干燥剂是因为其具有强氧化性 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
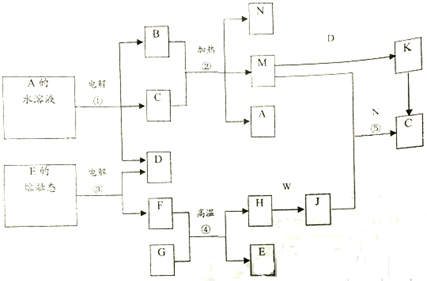
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
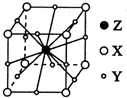 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂,化合物ZW2的晶体为离子晶体. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.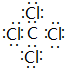
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与盐酸反应 | B. | 氧化铁与一氧化碳在高温下反应 | ||
| C. | 氧化铜与硫酸反应 | D. | 铁粉与硫酸铜溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
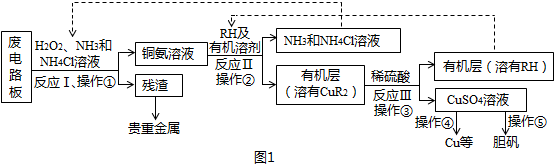
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
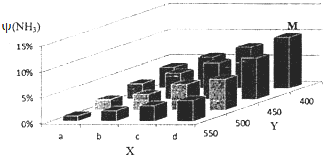 合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
合成氨的工业化生产,解决了世界粮食问题,是重大的化学研究成果.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用N2(g)+3H2(g)?2NH3(g)△H<0反应模拟哈伯合成氨的工业化生产.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2C2O4溶液:c(OH-)═c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)═2c(CO32-)+c(OH-) | |
| D. | CH3COONa和CaCl2溶液:c(Na+)+c(Ca2+)═c(CH3COO-)+c(OH-)+c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com