
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
科目:高中化学 来源: 题型:解答题
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: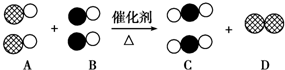
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 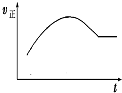 绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)?2C(g),如图为其正反应速率随时间变化的示意图,则该反应为放热反应 | |
| B. | 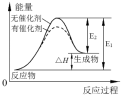 催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率.如图显示的是催化反应与无催化反应过程中的能量关系 | |
| C. |  将BaO2放入密闭真空容器中,反应2BaO2(s)?2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的$\frac{1}{2}$,体系重新达到平衡,体系压强变化如图所示 | |
| D. | 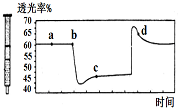 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)?N2O4(g),如图表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).则c点与a点相比,c(NO2)增大,c(N2O4)减小. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
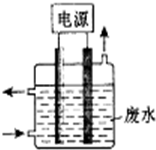 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
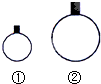
| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ①②④⑤ | C. | ② | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
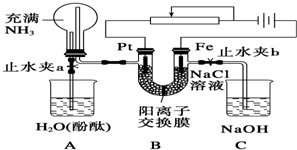
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com