
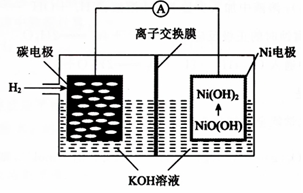
| A. | 离子交换膜选用阳离子交换膜(只允许阳离子通过) | |
| B. | 正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| C. | 导线中通过1mol电子时,理论上负极区溶液质量增加1g | |
| D. | 充电时,碳电极与电源的正极相连 |
分析 放电时,该装置是原电池,负极上失电子发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+2e-═Ni(OH)2+OH-;充电时,该装置是电解池,负极碳电极与电源的负极相连,正极Ni电极与电源的正极相连.
解答 解:A.放电时,该装置是原电池,负极上失电子发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+2e-═Ni(OH)2+OH-,所以离子交换膜选用阴离子交换膜,故A错误;
B.放电时,该装置是原电池,正极上得电子发生还原反应,电极反应式为NiO(OH)+H2O+2e-═Ni(OH)2+OH-,故B正确;
C.导线中通过1mol电子时,负极上失电子发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,则有0.5mol氢气参加反应,溶液质量增加1g,同时有1molOH-,通过阴离子交换膜进入负极,则溶液又增加17g,所以理论上负极区溶液质量增加18g,故C错误;
D.充电时,负极碳电极与电源的负极相连;故D错误;
故选:B.
点评 本题考查了原电池和电解池原理,明确各个电极上得失电子及反应类型是解本题关键,难点是电极反应式的书写,要结合电解质溶液书写,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 98g硫酸的摩尔数为1 mol | B. | 氧的摩尔质量为32g/mol | ||
| C. | 阿伏加德罗常数约为6.02×1023个 | D. | 某硫酸中H2SO4的质量分数为0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热TiCl4浓溶液制备TiO2•xH2O2:Ti4++(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O+4H+ | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量KOH溶液:NH4++OH-═NH3↑+H2O | |
| C. | 钢铁发生吸氧腐蚀时的正极反应:O2+4H++4e-═2H2O | |
| D. | 酸性KI溶液中通入O2:4H++2I-+O2═2H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1盐酸滴定10mL a mol•L-1氨水,盐酸的体积V(HCl)与溶液的pH关系如图所示,下列说法正确的是( )| A. | A点溶液中加少量水,$\frac{c({H}^{+})}{c(N{{H}_{4}}^{+})}$减小 | |
| B. | 原氨水的物质的量浓度约为1.006×10-2mol•L-1 | |
| C. | A、B、C三点溶液中水电离出来的c(OH-):A>B>C | |
| D. | C点时,盐酸和氨水恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在$\frac{c(H+)}{c(OH-)}$=1012的溶液中,Fe2+、I-、NO3-、Cl-一定不能大量共存 | |
| B. | H2A是二元弱酸,常温下,0.1mol/LNaHA溶液的pH约为5,说明HA-电离程度大于水解程度 | |
| C. | 使用催化剂一定能够降低化学反应的反应热(△H) | |
| D. | NA为阿伏加德罗常数的值,常温常压下,28gC2H4和C3H6混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
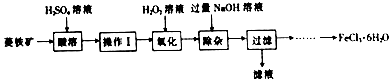
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com