

分析 (1)根据钠与水反应生成了氢氧化钠及铝与氢氧化钠反应生成了偏铝酸钠和氢气,据此写出反应的离子方程式;根据反应计算出生成的氢气、偏铝酸钠的物质的量及质量,再根据溶质质量分数的公式求出溶液的溶质质量分数;
(2)在标准状况下,22.4升的密闭容器中充入CO2和CO混合气体,物质的量n=$\frac{22.4L}{22.4L/mol}$=1mol,其密度为$\frac{10}{7}$g/L,质量=$\frac{10}{7}$g/L×22.4L=32g,气体平均摩尔质量M=32g/mol,计算得到二氧化碳和一氧化碳物质的量,结合化学方程式定量关系计算;
(3)镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为氧化镁,氧化镁质量等于合金的质量,利用组成可知氧化镁中O元素的质量等于合金中Al的质量,以此来解答;
(4)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据2Fe2++Br2═2Fe3++2Br-知,还原性Fe2+>Br-,所以向溴化亚铁溶液中通入氯气时,氯气先和Fe2+反应后和Br-反应,将氯气通入溴化亚铁溶液中时有$\frac{1}{3}$的溴离子被氧化成溴单质,说明亚铁离子完全被氧化,根据转移电子守恒进行计算;
(5)根据最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量$\frac{5.76g-3.2g-2.24g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气;
解答 解:(1)钠和水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
铝与碱反应生成偏铝酸钠和氢气,所以化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,则离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
由反应离子方程式可知,钠和铝反应的物质的量之比为1:1,所以将amol钠和amol铝一同投入mg足量水中,钠、铝能恰好反应最终得到amolNaAlO2,
根据方程式知反应过程中共得到H2的物质的量为:$\frac{1}{2}$a+$\frac{3}{2}$a=2amol,生成NaAlO2的物质的量为amol,
则所得溶液中溶质的质量为:amol×82g/mol=82ag,溶液的质量为:23ag+27ag+mg-4ag=(46a+m)g,
故所得溶液的溶质质量分数为:ω(NaAlO2)=$\frac{82ag}{(46a+m)g}$×100%=$\frac{8200a}{46a+m}$%,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;$\frac{8200a}{46a+m}$%.
(2)在标准状况下,22.4升的密闭容器中充入CO2和CO混合气体,其密度为10/7g/L,加入足量Na2O2充分振荡并不断用点火花点燃至完全反应,过氧化钠足量,最后容器中剩余的只有O2、Na2CO3和Na2O2,依据碳元素守恒得到最后得到碳酸钠物质的量为1mol,在标准状况下,22.4升的密闭容器中充入CO2和CO混合气体,物质的量n=$\frac{22.4L}{22.4L/mol}$=1mol,其密度为$\frac{10}{7}$g/L,质量=$\frac{10}{7}$g/L×22.4L=32g,气体平均摩尔质量M=32g/mol,设二氧化碳物质的量为x,CO物质的量为y,则:
x+y=1mol,
44x+28y=32
x=0.25mol,
y=0.75mol,
2Na2O2+2CO2=2Na2CO3+O2,2CO+O2=2CO2,最后容器中剩余氧气物质的量为0.125mol,
故答案为:0.125;1;
(3)由镁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化镁,则经洗涤、干燥、灼烧,得到白色粉末为MgO,MgO的质量等于合金Mg、Al的质量,所以MgO中O元素的质量等于合金中Al的质量,则合金中Mg的质量分数等于氧化镁中镁的质量分数:$\frac{24}{40}$×100%=60%,合金中铝的质量百分含量为40%,
故答案为:40%;
(4)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根据2Fe2++Br2═2Fe3++2 Br-知,还原性Fe2+>Br-,所以向溴化亚铁溶液中通入氯气时,氯气先和Fe2+反应后和Br-反应,将氯气通入溴化亚铁溶液中时有$\frac{1}{3}$的溴离子被氧化成溴单质,说明亚铁离子完全被氧化,设c(FeBr2)=xmol/L,
根据转移电子守恒得n(Fe2+)×1+n(Br-)×1=2n(Cl2),
即0.1xmol×1+0.2xmol×1×$\frac{1}{3}$=0.1mol×2,
x=1.2,
故答案为:1.2mol/L;
(5)根据最后溶液中溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,由于合金中氧物质的量$\frac{5.76g-3.2g-2.24g}{16g/mol}$=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08-0.04=0.04molH+生成氢气,即生成0.02mol氢气,标况体积为448ml,
故答案为:448;
点评 本题考查氧化还原反应有关计算、混合物的有关计算、化学方程式计算等,为高频考点,明确离子反应先后顺序、发生的反应找出合金与氧化物的关系是解本题关键,结合转移电子守恒分析解答,侧重考查学生的分析、理解能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 天然物质都是绿色无毒的物质 | B. | 只饮用纯净水有益人体健康 | ||
| C. | 禁止吸烟可减少室内空气污染 | D. | 微量元素只能通过保健品摄入 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )
在200mL含Mg2+、Al3+、NH4-、H+、Cl-等离子的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示.下列叙述正确的是( )| A. | .原溶液的c(H+)=0.08mol/L | B. | 原溶液中n(Mg2+):n(Al3+)=10:1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.066mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同位素1H的相对原子质量 | |
| B. | 氢元素的平均相对原子质量 | |
| C. | 氢元素各同位素质量数与百分含量算出的平均值 | |
| D. | 同位素2H的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中新月形分子和环状分子“组合”在一起,铜离子起关键作用 | |
| B. | 利用此方式可以合成新分子,同时也可能创造一种全新“机械键” | |
| C. | 在创造新分子技术中,铜离子是唯一可以借助的金属离子 | |
| D. | 此技术可以“互锁”合成 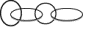 分子,甚至成更复杂的分子 分子,甚至成更复杂的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 | |
| B. | 用反应热数据的大小判断不同反应反应速率的快慢 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 用平衡常数的大小判断化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
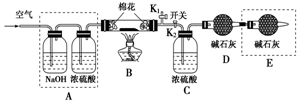 为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x
为探究所得的水合碱式碳酸镁[mMgCO3•nMg(OH)2•x查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙变红的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃时,水电离出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com