
下列说法中错误的是( )
|
| A. | 从1L 1mol•L﹣1的NaCl溶液中取出10mL,其浓度仍是1mol•L﹣1 |
|
| B. | 制成0.5L 10mol•L﹣1的盐酸,需标准状况下氯化氢气体112L |
|
| C. | 0.5L 2mol•L﹣1 BaCl2溶液中,Ba2+和Cl﹣总数为3×6.02×1023 |
|
| D. | 10g 98%硫酸(密度为1.84g•cm﹣3)与10mL 18.4 mol•L﹣1硫酸的浓度是不同的 |
考点:
物质的量浓度的相关计算.
专题:
物质的量浓度和溶解度专题.
分析:
A、根据溶液为均一、稳定的混合物来分析.
B、根据n=c•v和V=n•Vm来计算.
C、根据n=c•v和N=n•NA来计算.
D、据c=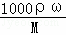 来计算.
来计算.
解答:
解:A、溶液为均一、稳定的混合物,从1L 1mol•L﹣1的NaCl溶液中取出10mL,浓度不变,浓度仍是1mol•L﹣1,故A正确.
B、制成0.5L 10mol•L﹣1的盐酸,需要n(HCl)=c•v=0.5L×10mol•L﹣1=5mol,标准状况下体积V(HCl)=n•Vm=5mol×22.4mol•L﹣1=112L,故B正确.
C、0.5L 2mol•L﹣1 BaCl2溶液中,n(BaCl2)=c•v=0.5L×2mol•L﹣1=1mol,由BaCl2的构成可知,1molBaCl2含3mol离子,即3×6.02×1023个,故C正确.
D、据c= 可知,98%硫酸(密度为1.84g•cm﹣3)的物质的量浓度c=
可知,98%硫酸(密度为1.84g•cm﹣3)的物质的量浓度c=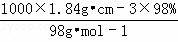 =18.4mol•L﹣1,与10mL 18.4 mol•L﹣1硫酸的浓度是相同的,故D错误.
=18.4mol•L﹣1,与10mL 18.4 mol•L﹣1硫酸的浓度是相同的,故D错误.
故选D.
点评:
本题考查的是物质的量浓度和离子数目的相关计算,注意物质的量公式的相关应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的值,下列说法正确的是()
A. 常温常压下,8 g O2含有电子数目为4NA
B. 1 L 0.1mol/L的氯化铵溶液中NH4+的数目为0.1NA
C. 常温常压下,22.4L氯气与足量的镁粉反应,转移的电子数为2NA
D. 含1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为()
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去KCl中的Ca2+,Mg2+,SO42﹣及泥沙,得到纯净的KCl,可将固体溶于水,然后在下列操作中选取必要的步骤和最佳的操作顺序( )
①过滤 ②加过量KOH溶液 ③加适量盐酸 ④加过量K2CO3溶液 ⑤加过量BaCl2溶液.
|
| A. | ②①⑤①④①③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
两个体积相同的密闭容器一个盛氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的是( )
|
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
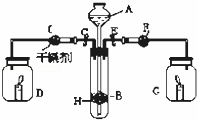
为证明有关物质的性质,某学生设计了如图所示的装置.当打开活塞C,使液体A与隔板H上的固体B相遇时,即有气体产生,并发现D中蜡烛熄灭;关闭C 打开E时,则看到G中蜡烛燃得更亮,且F中盛放固体为淡黄色.
(1)请判断各仪器中盛放的物质的化学式:
A ; B ;F .
(2)用化学反应方程式表示上述有关反应(不包括蜡烛的燃烧): , 2 , .
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 A B C D E F
混
合
溶
液 4mol/LH2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
时间(min) 15 10 5 3 6 9
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因 ;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2: .
(4)请你设计实验验证上述假设1,完成下表内容.
实验方案(不要求写具体操作过程) 预期实验结果和结论
,
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com