
【题目】下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44—和SO42—
A. 全部B. 除①④⑥以外C. ③④⑤⑥D. ②⑤⑥
【答案】C
【解析】
根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=![]() ×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断。
×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断。
①NH3中价层电子对个数=3+![]() ×(5-3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+
×(5-3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+![]() ×(6-2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误;
×(6-2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误;
②NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+![]() (6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
③NH3为三角锥形结构、H3O+中O原子价层电子对个数=3+![]() (6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
④O3、SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故④正确;
⑤CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+![]() (4-2×2)=2,二氧化碳是直线型结构,乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,为直线形结构;CO2和C2H2分子都是直线型分子,故⑤正确;
(4-2×2)=2,二氧化碳是直线型结构,乙炔的结构式为H-C≡C-H,每个碳原子价层电子对个数是2且不含孤电子对,为直线形结构;CO2和C2H2分子都是直线型分子,故⑤正确;
⑥SiO44-中价层电子对个数=4+![]() (4+4-4×2)=4,不含孤电子对,所以是正四面体形,SO42—中价层电子对个数=4+
(4+4-4×2)=4,不含孤电子对,所以是正四面体形,SO42—中价层电子对个数=4+![]() (6+2-4×2)=4,不含孤电子对,所以是正四面体形,两者空间构型相同,故⑥正确;
(6+2-4×2)=4,不含孤电子对,所以是正四面体形,两者空间构型相同,故⑥正确;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。

实验记录如下:

请回答下列问题:
(1)A中反应的离子方程式是__________________________________________________。
(2)实验操作Ⅱ吹入热空气的目的是_________________________________________。
(3)装置C的作用是____________,C中盛放的药品是_____________。
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式_______________________。
(5)由上述实验得出的结论是_________________________________________________。
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是_____________________________________________________________________。
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___族。写出其基态原子的电子排布式_____。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___.(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____。
(3)Cu可以和EDA(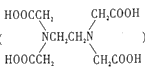 )形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
)形成配合物,其中碳原子的杂化方式是____,其中C、N、O的电负性由大到小的顺序是_____。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____,O2中σ和![]() 健的个数比是______。
健的个数比是______。
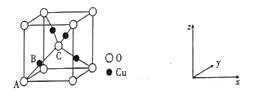
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(![]() ,
,![]() ,
,![]() ),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
),则B原子坐标是____。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加德罗常数的值,则氧化亚铜的密度是_____g·cm—3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的过程中的能量变化情况,判断下列说法正确的是

A. N2(g)转化为氮原子是一个放热过程
B. 1mol N2和lmol O2的总能量比2molNO的总能量高
C. 1个NO(g)分子中的化学键断裂时需要吸收632kJ能量
D. 2NO(g)=N2(g)+O2(g)的反应热△H=-180 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内不同化学元素所组成的化合物,以下说法不正确的是( )
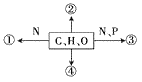
A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若③为多聚体,且能贮存生物的遗传信息,则③一定是RNA
C. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
D. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式____________。
(2)用电子排布图表示F元素原子的价电子排布图________________。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为_____________________。
(4)离子半径D+______B3-,第一电离能B______C,电负性C______F(填“<”、“>”或“=”)。
(5)A、C形成的两种常见分子电子式_____________;_____________(其中一种为绿色氧化剂)常见阴离子电子式为______________________。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X(只含两种短周期元素)是一种重要的还原剂。某同学取X做了如下实验

请回答:
(1)X的电子式是____________。
(2)写出X与水反应的化学方程式____________。
(3)X在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置如图所示。回答下列问题:
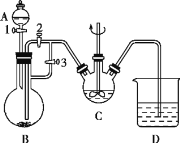
(1)C仪器的名称是___,FeCO3在其中生成,该装置中发生的主要反应的离子方程式为___。
(2)实验时首先打开活塞3,关闭活塞2,再打开活塞1向B中滴加盐酸,其目的是___,关闭活塞1,一段时间后,再关闭活塞___打开活塞__,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中。
Ⅱ.乳酸亚铁晶体((CH3CH(OH)COO)2Fe·3H2O,Mr =288g/mol)是常用的补铁剂。乳酸亚铁可由乳酸与碳酸亚铁反应制得。
(3)将制得的FeCO3加入乳酸溶液中,再加入过量铁粉,75℃下搅拌使之充分反应,结束后,无需过滤,除去过量铁粉的反应方程式为2CH3CH(OH)COOH+Fe=(CH3CH(OH)COO)2Fe+H2↑;从上述所得溶液中获得乳酸亚铁晶体的方法是____、过滤、洗涤、干燥。
(4)该兴趣小组用KMnO4测定产品中亚铁含量进而计算乳酸亚铁晶体的质量分数。发现产品的质量分数总是大于100%,其原因可能是___。
经查阅文献后,该兴趣小组改用铈(Ce)量法测定产品中Fe2+的含量。取2.880g产品配成100mL溶液,每次取20.00mL,进行必要处理,用0.1000mol·L-1的Ce(SO4)2标准溶液滴定至终点,平均消耗Ce(SO4)2标准溶液19.70mL。滴定反应为Ce4++Fe2+=Ce3++Fe3+,则产品中乳酸亚铁晶体的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com