
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用(如图所示)。下列做法与上述理念相违背的是( )

A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】某有机物其结构简式如图,关于该有机物,下列叙述不正确的是

A.能使酸性KMnO4溶液、溴水褪色,原理相同
B.1 mol 该有机物能与H2发生反应,消耗H2 4 mol
C.一定条件下,能发生加聚反应
D.该有机物苯环上的一个H被取代,有3种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学设计了如下装置进行试验探究,请回答下列问题:
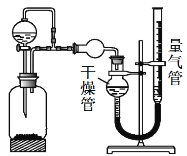
(1)为准确读取量气管的读数,除视线应与量气管凹液面最低处水平,还应注意 。考虑到分液漏斗滴入瓶中液体的体积(其它操作都正确),则该装置测得气体的体积将 (填“偏大”、“偏小”或“无影响”)。
(2)若在瓶中放入生铁,用此装置验证生铁在潮湿空气中发生吸氧腐蚀。
①通过分液漏斗向瓶中加入的试剂可选用下列 (填序号)
a.NaOH溶液 B.C2H5OH c.NaCl溶液 D.稀硫酸
②能证明生铁在潮湿空气中发生吸氧腐蚀的现象是 。
(3)若瓶中放入粗铜片(杂质不参与反应),分液漏斗内放稀硝酸,通过收集并测量NO气体的体积来探究粗铜样品的纯度。你认为此方法是否可行 (填“可行”或“不可行”),若填“不可行”请说明原因 。
(4)为探究MnO2在H2O2制取O2过程中的作用,分别将等量 H2O2加入到瓶中,进行2次实验(气体体积在同一状况下测定):
序号 | 瓶中的物质 | 分液漏斗的物质 | 测得气体体积 |
实验1 | 足量MnO2 | 20mL H2O2 | V1 |
实验2 | 稀硫酸和足量MnO2 | 20mL H2O2 | V1<V2<2V1 |
若实验1中MnO2的作用是催化剂,则实验2中发生反应的化学方程式为 。
(5)若瓶中放入镁铝合金,分液漏斗内放NaOH溶液,分别进行四次实验,测得以下数据(气体体积均已换算成标准状况):
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
Ⅰ | 1.0 g | 10.00 mL | 346.30 mL |
Ⅱ | 1.0 g | 10.00 mL | 335.50 mL |
Ⅲ | 1.0g | 10.00 mL | 346.00 mL |
Ⅳ | 1.0 g | 10.00 mL | 345.70 mL |
则镁铝合金中镁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是
A. pH=7的溶液
B. c(H+)=c(OH-)=10-6 mol·L-1的溶液
C. c(H+)水=c(OH-)水的溶液
D. 酸与碱恰好完全反应生成正盐的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙烯中往往混有CO2、SO2、H2O (气体少量)。请回答下列问题:
(1)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2、SO2、H2O(g)和乙烯,按气流的方向,各装置的连接顺序是:___________________。
(已知:SO2不能使Br2的CC14 溶液褪色)
① | ② | ③ | ④ | ⑤ |
|
|
|
|
|
(2)能说明有SO2的现象是_______。能说明有CO2的现象是____________。
(3)装置②中所加的试剂是___________,简述确定装置②在整套装置中的位置的理由是____。
(4)装置①的B中的酸性高锰酸钾溶液发生的炉子方程式为:_________。
(5)工业上用乙烯和水制取乙醇,该反应的类型为______反应。写出HCOOH和CH3CH218OH在浓硫酸作用下发生的化学方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。

(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1molCO2转移电子的物质的量是_________。
②过程2反应的化学方程式是__________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
按投料比n(CO2) : n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。

①正反应的焓变△H_______0 。
②提高CO2的转化率,可采用的方法是_______。
A.减小n(CO2)与n(H2)的投料比
B.改变催化剂
C.缩小容器体积
③图中表示乙烯的曲线是_______。
(3)以NH3与CO2为原料,合成尿素[化学式:CO(NH2)2]:
反应如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2与NH3形成液态水时,合成尿素的热化学方程式是_______________;
(2)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极,将CO2转化为丙烯的原理模型。

①太阳能电池的负极是_________。
②生成丙烯的电极反应式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
①乙酸与乙醇反应生成乙酸乙酯;②乙烯通入溴水中;③在镍作催化剂的条件下,苯与氢气反应;④苯与液溴混合后撒入铁粉
A. ①② B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com