
| A. | KCl | B. | PCl3 | C. | NH3•H2O | D. | Na2O2 |
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在18 g18O2中含有NA个氧原子 | |
| B. | 在氮原子中,质子数为7而中子数不一定为7 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | Cl-的结构示意图为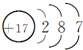 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
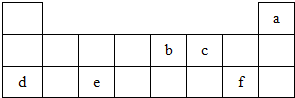
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
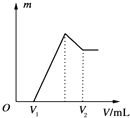 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H2m-nR | |
| B. | 除第ⅡA族族外,其余各族都有非金属元素 | |
| C. | 同一主族相邻的两种元素的原子序数之差可能为16 | |
| D. | 同一短周期元素的原子半径从左到右逐渐减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com