
用价电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
下表是几种氯化物的熔点和沸点:
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 熔点/℃ | 801 | 714 | 190(5×101 kPa) | -70 |
| 沸点/℃ | 1 413 | 1 412 | 180 | 57.57 |
据表中所列数据判断下列叙述与表中相吻合的是( )
A.AlCl3在加热条件下不能升华
B.SiCl4晶体属于原子晶体
C.AlCl3晶体是典型的离子晶体
D.SiCl4在晶体中有分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.离子晶体中每个离子的周围均吸引着6个带相反电荷的离子
B.金属导电的原因是在外加电场作用下金属产生自由电子,电子定向运动
C.分子晶体的熔、沸点很低,常温下都呈液态或气态
D.原子晶体中的各相邻原子都以共价键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
在形成氨气分子时,氮原子中的原子轨道发生sp3杂化生成4个________________,生成的4个杂化轨道中,只有________个含有未成对电子,所以只能与____________个氢原子形成共价键,又因为4个sp3杂化轨道有______________,所以氨气分子中的键角与甲烷不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2===CH2 ③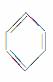 ④CH≡CH
④CH≡CH
⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
有下列九种晶体:A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石 I.镁
(1)属于原子晶体的化合物是________,直接由原子构成的晶体是________,直接由原子
构成的分子晶体是________。
(2)由极性分子构成的晶体是________,含有共价键的离子晶体是________,属于分子晶
体的单质是________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是________,需要克服金属键的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则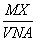 表示的是( )
表示的是( )
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com