
 甲醇(CH3OH)是一种优质燃料,
甲醇(CH3OH)是一种优质燃料,分析 (1)①根据n=$\frac{m}{M}$计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;
②反应热与化学计量数成正比,根据热化学方程式计算;
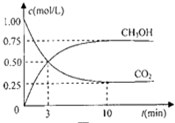
(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;
①依据化学平衡三段式列式利用V=$\frac{△c}{△t}$计算;
②依据升温,增加浓度,加压,加催化剂等可以加快反应速率判断;
③可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.
解答 解:(1)①88gCO2的物质的量为n=$\frac{m}{M}$=$\frac{88g}{44g•mo{l}^{-1}}$=2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol;
②每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,若生成3mol甲醇放出的热量为49kJ×3=147kJ,
故答案为:147kJ;
(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
H2的平均反应速率v(H2)=$\frac{△c}{△t}$=$\frac{2.25mol•{L}^{-1}}{10min}$=0.225mol•L-1•min-1 ,
故答案为:0.225mol•L-1•min-1 ;
②A.加入催化剂,v (CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物浓度不变,所以v (CO2)不变,故B错误;
C.将H2O(g)从体系中分离,则生成物浓度减小,则浓度减小,故C错误;
D.升高温度,v (CO2)增大,故D正确;
故答案为:AD;
③A.反应前后气体的体积不等,所以压强一直在变,则当压强不变时能说明达到平衡,故A正确;
B.反应前后质量不变,体积也不变,所以密度一直不变,则混合气体的密度不再变化不能说明达到平衡,故B错误;
C.CO2、H2和CH3OH的浓度不再变化,说明达到平衡,故C正确;
D.单位时间内消耗3molH2的同时生成1molCH3OH,都是指正反应方向,不能说明达到平衡,故D错误;
E.CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol,CO2结构简式为O=C=O,1个分子有2个C=O键,当2个C=O键断裂的同时,必有3个H-H键断裂,与是否已达到平衡无关,故E错误;
故答案为:AC.
点评 本题考查了热化学方程式的书写原则,化学反应速率、平衡状态的判断以及化学平衡的计算的应用,图象分析是关键,综合性较大,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+ (过氧乙酸)→ (过氧乙酸)→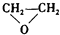 +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Ca(OH)2→ +CaCl2+H2O +CaCl2+H2O | |
| C. | 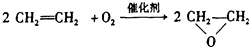 | |
| D. | 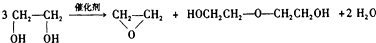 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | B. | A和B不可能是同系物 | ||
| C. | A和B的实验式一定相同 | D. | A和B的化学性质一定相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(Na+)>r(Na) | B. | r(Cl)>r(Cl-) | C. | r(Na)>r(Mg) | D. | r(F)>r(Cl) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>C>N | B. | 热稳定性:HI<HBr<HCl<HF | ||
| C. | 最高正化合价:Si<P<S<Cl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3>KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com