
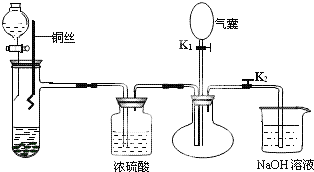


科目:高中化学 来源: 题型:
| A、溶液中c(CO32-):c(HCO3-)<1:1 |
| B、溶液中c(OH-)+(CO32-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D、将混合液蒸干,水解加剧,最终得NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次减小 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、混合气体的分子数目 |
| D、混合气体的总物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com