
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
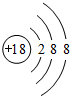 ,故答案为:
,故答案为: ;
;
| ||
| ||
| 1×2 |
| 16×1 |
| 1 |
| 8 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、成键过程中吸收能量 |
| B、断键过程中吸收能量,成键过程中释放能量 |
| C、断键过程中释放能量 |
| D、断键过程中释放能量,成键过程中吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
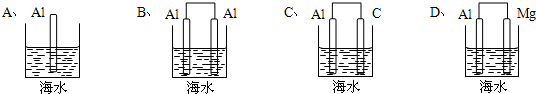
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)
Ⅰ.(1)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液中c(Na+)查看答案和解析>>
科目:高中化学 来源: 题型:
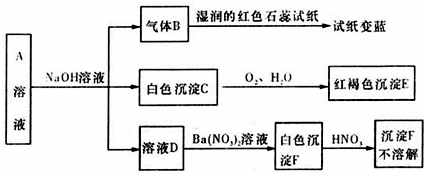
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CO2+C
| ||||
B、2Na+O2
| ||||
| C、Mg+2HCl═MgCl2+H2↑ | ||||
D、2Al+Fe2O3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com