
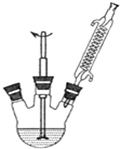
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O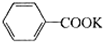 +HCl→
+HCl→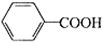 ↓+KCl
↓+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
分析 (1)根据溶液体积及三颈烧瓶所盛液体体积通常占其容积的$\frac{1}{3}$~$\frac{2}{3}$判断;
(2)根据物质的溶解性可知,完全反应时:溶液不分层、回流液不再出现油珠;
(3)温度较高时,苯甲酸溶解度增大,会溶解而损失;由表中数据可知,苯甲酸具有升华性质;
(4)①由表中数据可知,常温下苯甲酸微溶于水而易溶于乙醇;
②苯甲酸反应完毕,加入最后一滴NaOH溶液,溶液呈弱碱性,溶液变为浅红色;
③第三次与前两次消耗氢氧化钠的体积相差较大,应舍弃,第1、2次消耗氢氧化钠溶液的体积的平均值为氢氧化钠溶液体积,苯甲酸与氢氧化钠按1:1反应,则 n(苯甲酸)=n(NaOH),再根据m=nM计算m(苯甲酸),进而计算样品中苯甲酸的纯度.
解答 解:(1)溶液体积为120mL,而三颈烧瓶所盛液体体积通常占其容积的$\frac{1}{3}$~$\frac{2}{3}$,故三颈烧瓶的容积应为180mL~360mL,故选250mL三颈烧瓶,故选:B;
(2)反应中得到苯甲酸钾,而苯甲酸钾溶于水,甲苯不溶于水,完全反应时:三颈烧瓶内溶液不分层、回流液不再出现油珠,故答案为:三颈烧瓶内溶液不分层;
(3)温度较高时,苯甲酸溶解度增大,用少量冷水洗涤可以减少苯甲酸因溶解造成的损失;由表中数据可知,苯甲酸具有升华性质,可以利用升华法进行提纯,
故答案为:减少苯甲酸因溶解造成的损失;升华;
(4)①由表中数据可知,常温下苯甲酸微溶于水而易溶于乙醇,故配制溶液时用稀乙醇而不用蒸馏水作溶剂,故答案为:常温下苯甲酸微溶于水而易溶于乙醇;
②反应到达终点时,加入最后一滴NaOH溶液,溶液由无色变为浅红色,故答案为:加入最后一滴NaOH溶液,溶液由无色变为浅红色;
③第三次与前两次消耗氢氧化钠的体积相差较大,应舍弃,消耗氢氧化钠溶液的体积为$\frac{24.70mL+24.80mL}{2}$=24.75mL,苯甲酸与氢氧化钠按1:1反应,则n(苯甲酸)=n(NaOH)=0.1000mol•L-1 ×0.02475L=0.002475mol,则其总质量为0.002475mol×122g/mol×$\frac{100mL}{25mL}$=1.2078g,所以产品中苯甲酸质量分数为$\frac{1.2078g}{1.22g}$×100%=99.00%,故答案为:99.00%.
点评 本题考查制备实验方案设计、对实验操作分析评价、滴定原理的应用等,掌握反应原理是解答的关键,考查学生综合解题能力,题目难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | SO2的摩尔质量就是相对分子质量 | |
| C. | 1mol SO2的质量是64g/mol | |
| D. | 5mol SO2中含分子数约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 金属铝溶于氢氧化钠溶液 Al+2OH-=AlO2-+H2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com