
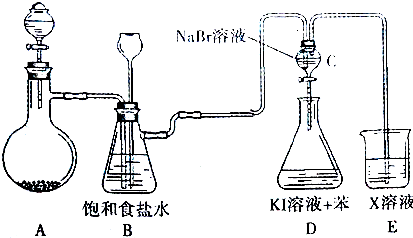
分析 (1)萃取的步骤:溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体;
(2)萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应;
(3)萃取实验使用的主要仪器是分液漏斗;碘溶于四氯化碳溶液呈紫红色.
解答 解:(1)萃取的步骤:检验分液漏斗活塞和上口的玻璃塞是否漏液,溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体,
故答案为:CBDAHGEF;
(2)汽油、四氯化碳、苯与水不互溶,碘在汽油、四氯化碳、苯中的溶解度比在水中的溶解度大,可以萃取;酒精与水互溶,不能做萃取剂,故答案为:B;
(3)萃取使用分液漏斗;碘易溶于四氯化碳,且碘溶于四氯化碳后溶液呈紫色,碘水为黄色,故水层为无色或淡黄色,故答案为:分液漏斗;紫红;无色或淡黄色.
点评 本题考查了分液和萃取,难度不大,萃取剂的选择原则是:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应.萃取是物质分离、提纯的常用物理方法.


科目:高中化学 来源: 题型:选择题
| A. | ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子还原性从上到下依次减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 食物 | 牛奶 | 小麦粉 | 大米 | 猪肉 | 鱼肉 | 牛肉 | 鸡蛋 | 小白菜 | 苹果 | 植物油 |
| 食量(g) | 250 | 50 | 400 | 50 | 150 | 50 | 50 | 250 | 400 | 50 |
| 大米 | 小麦粉 | 牛奶 | 鸡蛋 | 猪肉 | 牛肉 | 鱼肉 | 小白菜 | 苹果 | 植物油 | |
| 蛋白质(g) | 7.4 | 11.2 | 3.0 | 12.7 | 20.3 | 20.2 | 16.6 | 1.5 | 0.2 | 0 |
| 油脂(g) | 0.8 | 1.5 | 3.2 | 9.0 | 6.2 | 2.3 | 5.2 | 0.3 | 0.2 | 100 |
| 糖类(g) | 77.2 | 71.5 | 3.4 | 1.5 | 1.5 | 1.2 | 0 | 1.6 | 12.3 | 0 |
| 维生素B1(mg) | 0.11 | 0.28 | 0.03 | 0.09 | 0.54 | 0.07 | 0.04 | 0.02 | 0.06 | 0 |
| 维生素C(mg) | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 28 | 4 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)=2c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)>c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHS溶液中离子浓度关系:c (OH-)=c (H+)-c (S2-)+c (H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L Na2S溶液中:c(Na+)=2s(S2-)+2c(HS-)+2c(H2S) | |
| B. | 0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)>c(CO32-) | |
| C. | 0.1mol/L(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com